Conversion fonctionnelle de la peroxygénase en peroxydase dans le P450BM3-H facilité par le DFSM
La catalyse enzymatique est une solution verte prometteuse pour la production de produits pharmaceutiques, produits chimiques raffinés, produits chimiques en bon état, et les biocarburants. Cependant, explorer leur promiscuité catalytique pour étendre et améliorer les capacités des enzymes reste un défi.
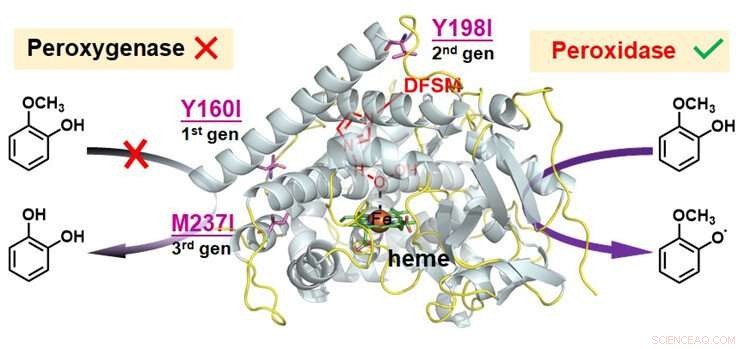
Une équipe de recherche dirigée par le Dr Cong Zhiqi du Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT) de l'Académie chinoise des sciences (CAS) a appliqué une stratégie d'ingénierie des protéines consistant à muter des résidus sensibles à l'oxydoréduction qui permet au système de peroxygénase d'obtenir une peroxydase efficace. activité.
L'étude a été publiée dans Catalyse ACS le 28 juin.
Dans leur étude précédente, les chercheurs ont signalé un H unique
Pour étendre la promiscuité catalytique du P450-H facilité par le DFSM
Ils ont identifié des points chauds de résidus sensibles à l'oxydoréduction, puis utilisé un petit nombre d'acides aminés logiquement choisis pour échanger les résidus aux points chauds.
Après avoir combiné plusieurs mutations itératives de résidus sensibles à l'oxydoréduction à différents sites, les chercheurs ont réalisé la fonction peroxydase du P450-H facilité par le DFSM
L'étude de simulation collaborative avec le Dr WANG Binju de l'Université de Xiamen a montré la possibilité de l'origine de l'activité de la peroxydase dans le P450BM3-H facilité par le DFSM
"L'étude fournit de nouvelles perspectives et stratégies pertinentes pour étendre la promiscuité catalytique des P450 en combinant les effets de l'ingénierie des protéines et des molécules exogènes, " a déclaré le Dr Cong.