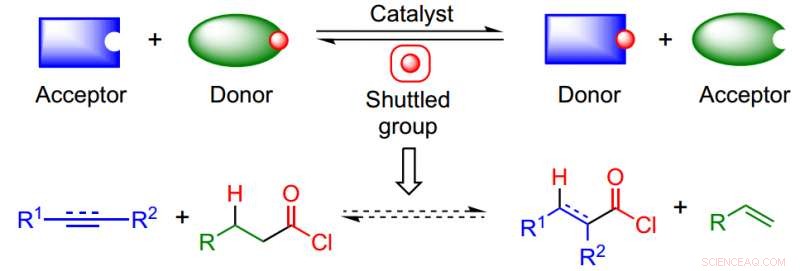
L'approche tire parti d'un processus de catalyse navette isodesmique pour éviter le besoin de CO et de HCl et surmonter le défi thermodynamique de fabriquer des produits hautement réactifs. Crédit: Chimie de la nature (2017). DOI :10.1038/nchem.2798
(Phys.org) - La synthèse de dérivés d'acide carboxylique à partir de composés carbonés insaturés est importante pour la fabrication de produits chimiques utilisés dans les produits pharmaceutiques, produits de beauté, polymères, et agrochimiques. Dans l'industrie, cette réaction est effectuée en utilisant du monoxyde de carbone à haute pression avec le catalyseur approprié pour le travail. Bien que cela puisse être possible dans certains établissements, l'utilisation d'un gaz toxique n'est pas possible en laboratoire. En outre, car ces réactions nécessitent souvent un catalyseur sur mesure, le processus est limité aux seuls substrats qui fonctionnent avec le catalyseur.
Des chercheurs de l'Institut Max Planck ont développé une synthèse beaucoup plus large et évitant l'utilisation de CO à haute pression et de gaz HCl corrosif. Xianjie Fang, Bastien Cacherat, et Bill Morandi a développé une nouvelle synthèse en un seul pot qui produit une variété d'acides carboxyliques ainsi que des amides et des thioesters. Leur synthèse utilise une navette catalytique qui donne le CO et le HCl nécessaires pour produire un intermédiaire de chlorure d'acide qui est ensuite converti en le produit souhaité. Leur travail apparaît dans Chimie de la nature .
La catalyse navette élimine le besoin d'utiliser des réactifs dangereux et ouvre la porte à l'utilisation de nucléophiles qui n'étaient pas accessibles dans d'autres conditions de réaction (c. Reppe carbonylation) Selon le Dr Morandi, "Le catalyseur agit efficacement comme une navette pour le transport d'un groupe chimique entre une molécule (donneur) et une autre molécule (accepteur) de manière réversible."
Dans ce document, les auteurs ont combiné un donneur de chlorure d'acide et un substrat insaturé pour produire le chlorure d'acide souhaité qui peut ensuite être converti en une large gamme de groupes fonctionnels utiles. Leur navette était Pd/xantphos, un système catalytique qui a été utilisé dans d'autres types de réactions d'alcène.
La clé de leur synthèse était de trouver une molécule donneuse de CO et HCl appropriée. Comme réaction modèle, Fang et al. cyclododécyne utilisé, un alcyne interne, et essayé divers chlorures d'acide aliphatique de bas poids moléculaire comme molécules donneuses. Ils ont déterminé que le chlorure de butyryle était leur meilleur candidat car il est peu coûteux, a un faible poids moléculaire, et a une bonne réactivité.
Ils ont ensuite étudié l'étendue de leur mécanisme de réaction. Plusieurs des alcynes internes qu'ils ont étudiés ne nécessitaient qu'un peu plus d'un équivalent de chlorure de butyryle et produisaient le produit chlorure d'acide souhaité avec de bons rendements. Par ailleurs, car la réaction est sensible aux effets stériques, les produits présentaient un excès d'un produit régio et réagissaient sélectivement à la position distale dans les cas où il y avait plus d'une option de réaction.
Les conditions de réaction fonctionnaient également pour les alcynes terminaux. Pour cette réaction, environ quatre équivalents de chlorure de butyryle étaient nécessaires et l'isomère ramifié a été isolé de la réaction pour donner le produit souhaité avec un bon rendement. Les auteurs ont noté qu'ils étaient capables d'isoler des produits d'acrylate d'alkyle, qui sont des composés importants pour la chimie des polymères. Ils ont également testé leur réaction avec des halogènes, alcools protégés, esters, une cétone, un nitrile, et les phtalimides, qui ont tous été bien tolérés dans cette réaction.
Fang et al. a également testé comment cette réaction s'est déroulée avec les alcènes. Ils ont produit des chlorures d'acide de bicyclette à partir d'alcènes filtrés avec de bons rendements. Les alcènes terminaux ont donné le chlorure d'acide correspondant avec des rendements adéquats.
L'étape suivante de leur procédure consistait à effectuer une synthèse en un seul pot en convertissant le chlorure d'acide en l'acide carboxylique correspondant, thioester, ou amide. Ils ont commencé par examiner les nucléophiles qui sont généralement inaccessibles une fois terminés les réactions précédemment signalées. Ceux-ci comprenaient un alcool tertiaire volumineux et du tocophérol. Ils ont également testé l'indole et un thiol tertiaire. Ils étaient également capables de conjuguer la cinchonine et l'estrone, deux molécules bioactives.
Finalement, leur synthèse en un seul pot a été testée pour voir si elle pouvait être utilisée pour fabriquer d'autres composés carbonylés. Ceux-ci ont nécessité l'utilisation de différents substrats initiaux et d'un second catalyseur. Celles-ci comprenaient des réactions de Friedel-Crafts ainsi que d'autres réactions de couplage pour fabriquer des cétones.
En ce qui concerne les implications plus larges de leur travail, Le Dr Morandi a déclaré que « ce travail démontre que la catalyse par navette n'est pas seulement une approche précieuse pour éviter l'utilisation de gaz toxiques, mais aussi un outil puissant pour découvrir une nouvelle réactivité qu'il est difficile d'obtenir autrement"
© 2017 Phys.org