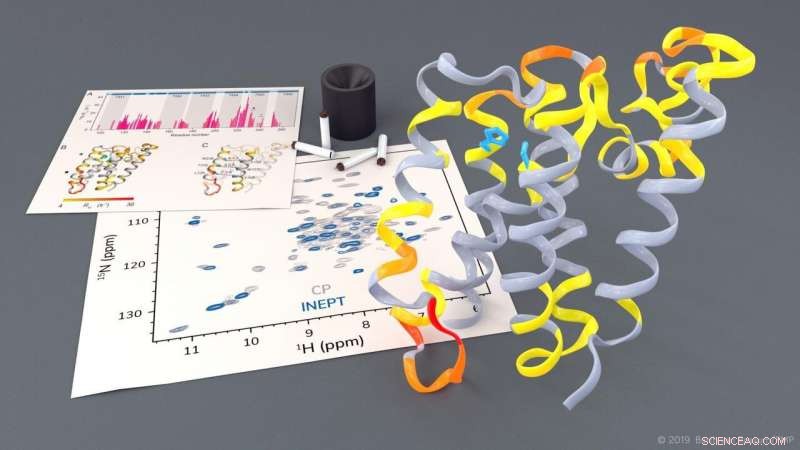
Investigation de la protéase rhomboïde GlpG par RMN du solide. Crédit :Barth van Rossum, FMP
Les protéases rhomboïdes sont des protéines membranaires cliniquement pertinentes qui jouent un rôle clé dans diverses maladies. En utilisant la spectroscopie RMN à l'état solide, Des chercheurs du Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) de Berlin ont maintenant pu observer au travail des protéases rhomboïdes dans un environnement lipidique natif. Les images dynamiques obtenues seront utiles pour le développement de nouveaux médicaments pour des maladies telles que la maladie de Parkinson et le paludisme. Les résultats de ces travaux pionniers viennent d'être publiés dans le Journal de l'American Chemical Society .
Des dizaines de milliers de protéines sont à l'œuvre dans nos cellules, autour de l'horloge. Certains de ces travailleurs industrieux sont assis dans la membrane cellulaire, parmi eux la famille des protéases rhomboïdes. Étant donné que ces protéases intramembranaires sont impliquées dans de nombreux processus biologiques, et jouent également un rôle clé dans des maladies telles que la maladie de Parkinson, Diabète, cancer et paludisme, ils sont très pertinents sur le plan clinique.
Précédemment, il avait été possible de visualiser des protéases rhomboïdes en utilisant la cristallographie aux rayons X. Cependant, cette méthode n'a pu fournir que des images statiques de protéines dans un environnement artificiel. Par conséquent, il restait d'un grand intérêt de voir ce qui se passe dans la membrane cellulaire où les protéines accomplissent leur tâche principale, qui clive d'autres protéines membranaires, déclencher une cascade de signalisation.
La porte longtemps suspectée qui s'ouvre existe bel et bien
Le groupe de recherche dirigé par le professeur Adam Lange du Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) a maintenant été en mesure d'étudier ce processus très complexe, pour la première fois en utilisant la spectroscopie RMN à l'état solide dans un environnement de type natif. Les chercheurs ont pu observer comment certaines parties de la protéase se déplacent. Ils ont également remarqué que, pour cliver d'autres protéines, une porte s'ouvre brièvement pour permettre à ces protéines substrats d'entrer dans le centre actif de la protéase.
Résultats pertinents pour les interférences pharmacologiques
Le projet, entreprises au sein du Pôle d'Excellence UniSysCat, établit une base pour une caractérisation encore meilleure des protéases rhomboïdes. Qui plus est :les connaissances acquises seront utiles aux chercheurs pour étudier comment ils peuvent influencer pharmacologiquement les protéines membranaires cliniquement pertinentes. Lange et son équipe veulent également rechercher des substances pour inhiber les protéases rhomboïdes errantes.