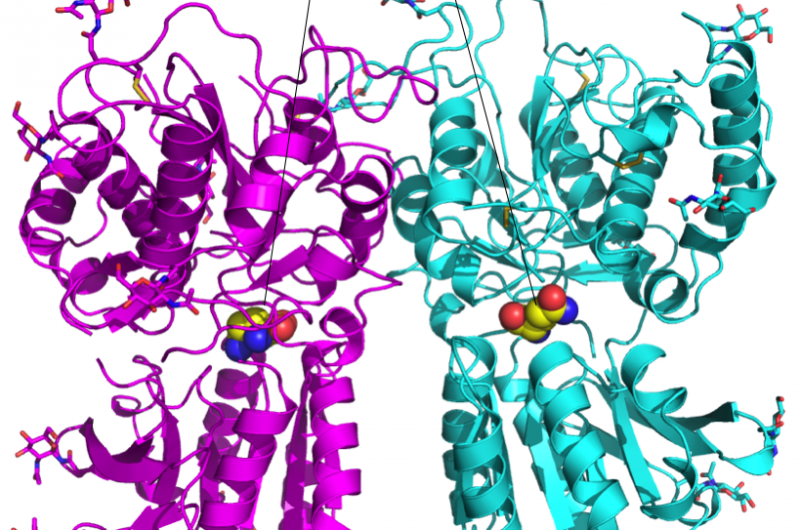
Figure 1 :Structure cristalline de l'hétérodimère du domaine de liaison au ligand du récepteur du goût T1r2-T1r3. Crédit :Université d'Okayama
Les récepteurs sont la façon dont le corps perçoit son environnement. Lors de la liaison d'un ligand, un récepteur initiera une chaîne d'événements qui déclenche une réponse. Notre système olfactif dépend d'environ 400 récepteurs pour nous donner notre odorat. Goût, cependant, fonctionne avec un nombre beaucoup plus petit :la combinaison de seulement trois membres de la famille des récepteurs du goût de type 1 (T1r) peut détecter une large gamme de saveurs sucrées et salées chez l'homme.
"Les hétérodimères T1r peuvent percevoir la plupart des substances gustatives sucrées et umami, " explique le professeur Junichi Takagi de l'Université d'Osaka. " Pour comprendre cette perception, nous avons examiné la structure atomique de l'hétérodimère."
Notre corps ressent une saveur lorsqu'un acide aminé de l'aliment se lie à un hétérodimère de deux membres T1r. Takagi est un expert en biologie structurale qui étudie les conformations physiques des récepteurs lors de la liaison à leurs ligands.
"La théorie du verrou et de la clé explique la plupart des liaisons ligand-récepteur. T1r est inhabituel car cette théorie ne semble pas s'appliquer. Nous avons pensé que cela ferait une étude de recherche intéressante."
Takagi a été approché par le professeur Atsuko Yamashita de l'Université d'Okayama qui étudiait l'hétérodimère T1r2-T1r3 du poisson medaka depuis des années. Cet hétérodimère se lie à une large gamme d'acides aminés pour la perception des saveurs salées. Pour mesurer la structure au niveau atomique, ils ont utilisé l'expertise de Takagi ainsi que l'équipement de rayonnement synchrotron de RIKEN SPring-8 au Japon.
L'équipe de recherche a découvert que la structure de l'hétérodimère était approximativement la même quel que soit l'acide aminé lié, mais l'affinité pour l'acide aminé était assurée avec les molécules d'eau à structure de coquille autour de l'acide aminé. Cette caractéristique pourrait expliquer comment un seul hétérodimère peut se lier à un réseau de ligands.
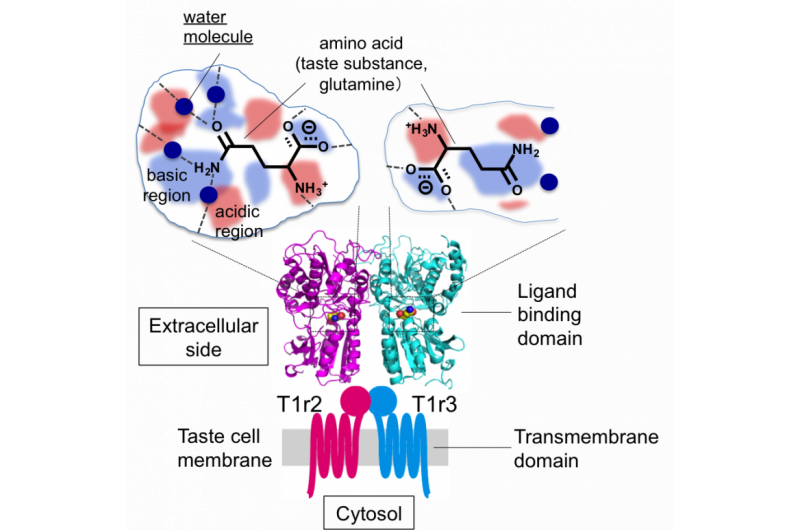
Figure 2 :Structure globale du récepteur du goût et dessin schématique des poches de liaison goût-substance. Crédit :Université d'Okayama
"Nous avons trouvé que l'espace dans lequel le ligand se lie à T1r2 est beaucoup plus grand que le ligand lui-même. Cet espace plus grand pourrait expliquer l'eau structurée, " a déclaré Yamashita. " L'espace dans les récepteurs de serrure et de clé est beaucoup plus petit. "
Une propriété similaire se trouve dans les récepteurs qui transmettent différents types de médicaments, suggérant que ce mécanisme peut être constant pour les récepteurs non spécifiques.
Bien que la formation de l'hétérodimère soit nécessaire à la perception, les résultats ont indiqué que T1r2 était responsable de la détection de différents acides aminés et que la liaison à T1r3 n'avait pas de rôle direct dans la reconnaissance des saveurs.
Pour des raisons de préparation des récepteurs, le groupe a choisi d'étudier l'hétérodimère T1r2-T1r3 du poisson medaka plutôt que la version humaine. Encore, parce que la famille T1r est universelle chez les animaux de niveau supérieur, ces résultats devraient constituer un modèle informatif pour la sensation gustative chez l'homme.