Les médicaments contenant de l'or sont utilisés depuis des siècles pour traiter des affections comme la polyarthrite rhumatoïde. En outre, ils pourraient être efficaces contre le cancer et le VIH. Un mécanisme par lequel ils fonctionnent pourrait se produire parce que les ions d'or forcent les ions de zinc à sortir des doigts de zinc - en boucle, domaines protéiques de liaison aux acides nucléiques. Des chercheurs américains ont caractérisé de tels "doigts d'or" en utilisant la spectrométrie de masse à mobilité ionique. Comme indiqué dans le journal Angewandte Chemie , ils ont identifié les sites exacts de liaison à l'or.
"Les ions zinc dans les doigts de zinc se lient à quatre atomes de soufre ou d'azote des résidus de cystéine et d'histidine de la protéine, " explique Nicholas P. Farrell de Virginia Commonwealth University (Richmond, ETATS-UNIS). "Les ions d'or se lient à seulement deux fragments d'acides aminés et modifient la conformation de la protéine. Les "doigts d'or" ne sont plus capables de se lier aux acides nucléiques, qui peut être thérapeutiquement utile."
Bien qu'il existe une variété de sites de liaison potentiels pour les ions métalliques, chaque métalloprotéine préfère généralement une seule conformation. Il n'était pas possible auparavant de déterminer où se trouvaient les sites de liaison spécifiques dans un mélange de conformères. Farrell et son équipe ont maintenant examiné de près deux doigts d'or. Selon Farrell, "le remplacement du zinc dans le doigt de zinc 3 du facteur de transcription Sp1 conduit à une seule espèce de doigt d'or." Les chercheurs ont identifié cela comme ayant une liaison linéaire Cys-Au-His. Dans le cas de la protéine de nucléocapside du VIH, qui joue un rôle essentiel dans la réplication du virus, "mettre de l'or dans le doigt de zinc 2 de la protéine (NCp7-F2), conduit à trois espèces différentes de doigts d'or avec des motifs linéaires Cys-Au-Cys, dont l'un est clairement prédominant."
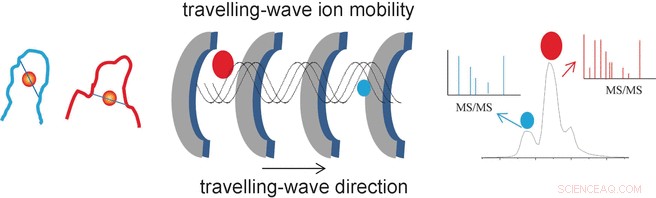
Le succès des chercheurs découle de leur utilisation d'une méthode analytique spéciale appelée spectrométrie de masse à mobilité ionique à ondes progressives (TWIM-MS). Dans cette technique, les molécules à analyser sont ionisées et les ions accélérés par un champ électrique dans un gaz. Les collisions avec les molécules de gaz provoquent un ralentissement des ions. Grand, les molécules volumineuses sont ralenties plus que les petites, compacts car ils se heurtent plus fréquemment. Cela permet également de différencier et de séparer les isomères, car bien qu'ils aient la même masse, leurs différentes géométries entraînent des mobilités différentes. Une fois séparés selon leur mobilité, les ions individuels peuvent maintenant être fragmentés par dissociation induite par collision (CID) et les fragments mesurés à nouveau par spectrométrie de masse. Cela permet de caractériser des peptides plus courts qui restent liés à l'or.
"De cette façon, nous avons pu identifier les sites et modes de liaison spécifiques pour les doigts de zinc modifiés à l'or NCp7-F2 et Sp1-F3, " dit Farrell. " La spectrométrie de masse à mobilité ionique fournit ainsi des informations importantes sur les changements de géométrie provoqués par l'échange de zinc dans les protéines à doigt de zinc, ainsi que la sélectivité et la réactivité de telles réactions. Cela pourrait être bénéfique dans la recherche de nouveaux médicaments antiviraux et antitumoraux à base de métaux. »