Résumé graphique. Crédit :hôte cellulaire et microbe (2022). DOI :10.1016/j.chom.2022.03.014
La phagothérapie, qui utilise des virus appelés bactériophages pour traiter les infections bactériennes, est un acte médical ancien dont les mécanismes d'action sont encore mal connus. Des scientifiques de l'Institut Pasteur et du CNRS ont démontré in vivo dans un modèle murin que les bactéries sont capables de réguler l'expression de leurs gènes pour échapper aux nombreux bactériophages présents dans l'environnement intestinal. Cette recherche explique la différence d'efficacité des bactériophages entre les conditions in vitro et in vivo. Les résultats ont été publiés dans la revue Cell Host &Microbe le 13 avril 2022.
La phagothérapie est une approche médicale qui consiste à traiter les maladies infectieuses bactériennes en utilisant la capacité naturelle de certains virus, appelés bactériophages, à tuer les bactéries qu'ils reconnaissent spécifiquement. Une baisse significative de l'utilisation de cette stratégie thérapeutique découverte il y a plus de 100 ans a été constatée en Occident suite au développement des antibiotiques. Cependant, face à une augmentation alarmante du nombre d'infections causées par des bactéries résistantes aux antibiotiques et à la perspective inquiétante de se retrouver sans options de traitement, les scientifiques cherchent à faire la lumière sur le mécanisme d'action des bactériophages.
Les bactéries et les bactériophages sont les entités les plus abondantes du microbiote intestinal humain. Bien que les bactériophages tuent les bactéries, les deux populations antagonistes coexistent en équilibre dans l'intestin.
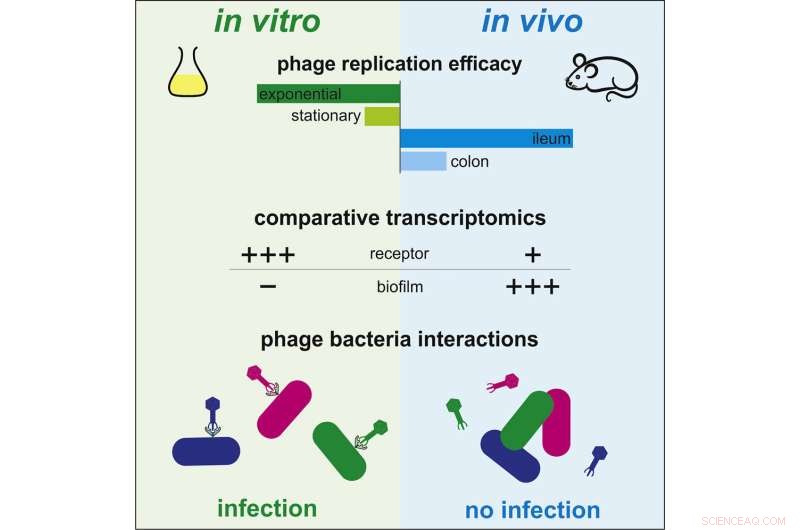
Jusqu'à présent, les données scientifiques disponibles étaient insuffisantes pour comprendre le fonctionnement de la phagothérapie in vivo. Les interactions entre bactéries et bactériophages ont, en revanche, été largement étudiées in vitro. Dans ces conditions, les bactériophages infectent rapidement les bactéries, se répliquent et détruisent les bactéries, tout en libérant de nouveaux virus capables d'infecter d'autres bactéries. Cependant, les dynamiques observées entre ces deux microorganismes sont très différentes dans l'intestin des mammifères. Certains bactériophages efficaces en milieu de culture sont totalement inefficaces en milieu intestinal.
Pour comprendre cette différence, des scientifiques de l'Institut Pasteur et du CNRS ont décidé de comparer le profil d'expression génique, ou transcriptome, de la bactérie Escherichia coli dans les deux contextes :milieu de culture et intestin. Grâce à cette méthode, ils ont mis en évidence des régulations génétiques qui caractérisent l'adaptation de la bactérie à l'environnement intestinal.
En examinant de près les gènes impliqués dans cette adaptation, ils ont mis en évidence quatre gènes qui modulent la sensibilité de la bactérie aux bactériophages. "Nous avons observé que certains gènes nécessaires à l'infection par les bactériophages s'expriment moins dans l'intestin qu'in vitro, protégeant ainsi les bactéries des bactériophages", commente Laurent Debarbieux, responsable de l'unité Bactériophage, Bactérie, hôte à l'Institut Pasteur (unité mixte CNRS) et dernier auteur de l'étude. Les scientifiques ont pu vérifier leur théorie en éliminant l'expression d'un gène particulier. Ils ont observé que la sensibilité bactérienne à un bactériophage était significativement réduite. Par conséquent, les bactéries de l'intestin sont capables de résister à la prédation par les bactériophages en modulant l'expression de certains gènes plutôt qu'en faisant muter leur génome.
Cette étude démontre donc que l'environnement joue un rôle prédominant dans les interactions entre bactéries et bactériophages. Ces découvertes ouvrent la voie à une meilleure utilisation des bactériophages à des fins thérapeutiques.