Résumé graphique. Crédit :Cellule moléculaire (2022). DOI :10.1016/j.molcel.2022.06.024
Publié dans la Cellule Moléculaire journal le 19 juillet, une étude de recherche du laboratoire Hatters a montré qu'une agrégation inappropriée de protéines est liée à de mauvais résultats pour la santé et la survie des cellules, en particulier dans les neurones dans les maladies neurodégénératives.
L'étude a examiné les forces motrices moléculaires qui font que les protéines mal repliées se collent anormalement et a examiné l'impact des protéines collantes sur les protéines environnantes dans une cellule, en particulier la façon dont les systèmes de protéostase détectent ces protéines collantes pour les empêcher de s'agréger.
La recherche est le résultat d'une collaboration entre le professeur Rohit Pappu de l'Université de Washington, des chercheurs de l'Université de Melbourne, dont un doctorat. étudiant et premier auteur égal, Yoon Hee Choi, professeur David Ascher, Dr Dezerae Cox et Angelique Haynes et chercheurs de l'Université de Leeds.
"Nous avons découvert qu'il y avait des protéines particulières qui régulent normalement le repliement des protéines - appelées chaperons moléculaires - qui sont très spécifiques à la détection de motifs d'autocollants particuliers. Il s'agit d'une découverte importante car elle informe sur la façon dont les cellules détectent lorsque les protéines s'agrègent anormalement", a déclaré le professeur Hatters. /P>
Les protéines sont fondamentales pour le fonctionnement des cellules et la survie et la prolifération des cellules nécessitent que les protéines se replient et se lient à d'autres protéines.
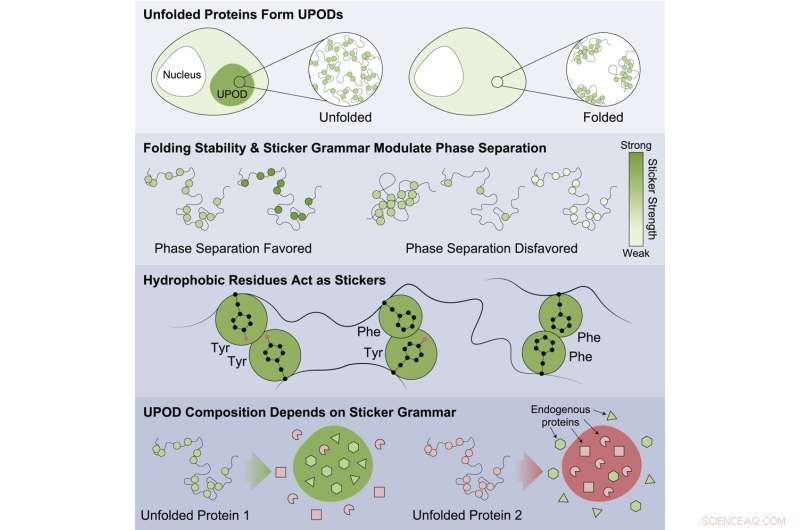
"Lorsque les protéines ne se replient pas correctement, les formes intermédiaires" mal repliées ", appelées dépôts de protéines non pliées (UPOD), peuvent s'agglutiner en agrégats. De tels agrégats apparaissent dans de nombreux contextes pathologiques, lorsque les systèmes moléculaires qui régissent le repliement et la clairance des protéines" ' tomber en panne", a déclaré Choi.
L'étude a mis en évidence que les protéines moins stables étaient plus susceptibles de s'agréger et d'être associées à la maladie. Les résultats suggèrent que cela se fait par l'agrégation inappropriée de formulaires mal pliés avec différentes sous-unités détectant différents codes "autocollants" qui dirigent l'agrégation. Les protéines sont impliquées dans un grand nombre de maladies, notamment les cancers, les troubles congénitaux, les maladies du système nerveux, les troubles du métabolisme et les maladies de la peau.
Des modèles spécifiques d'autocollants ont été trouvés qui étaient importants pour diriger l'agrégation et qui ont provoqué la co-agrégation d'autres protéines témoins environnantes dans la cellule. Les travaux ont montré que certaines classes d'acides aminés étaient les meilleurs autocollants - la tyrosine et la phénylalanine - et que le modèle des acides aminés était important pour la co-agrégation inappropriée des protéines témoins et la façon dont les chaperons moléculaires reconnaissaient les agrégats qui se formaient.
"La prochaine étape consiste à mieux comprendre les mécanismes de cela. Cela pourrait être utile dans les efforts futurs pour reprogrammer les cellules afin de mieux éliminer les agrégats de protéines, comme dans les maladies où ils s'accumulent abondamment", a déclaré le professeur Hatters.