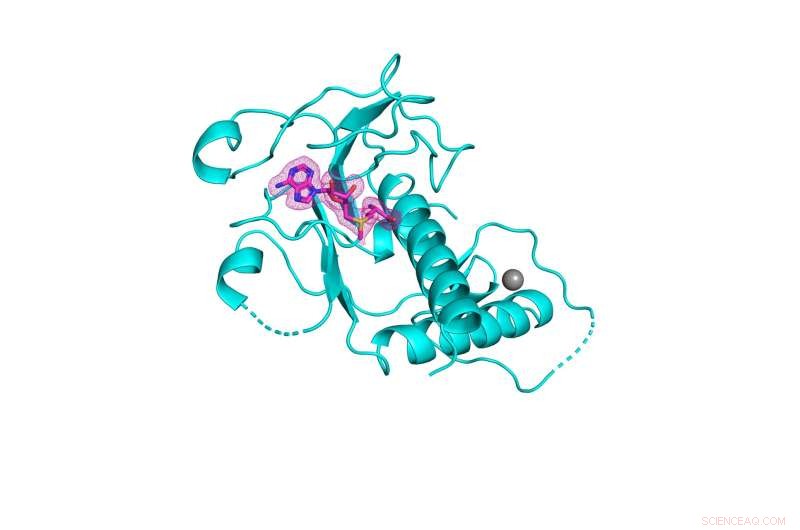
Structure 3D du domaine méthyltransférase SARS-CoV-2 nsp14 (représenté en cyan) lié à son cofacteur naturel S-adénosylméthionine (représenté en filet rose). Crédit :Kottur, et al ; Biologie structurale et moléculaire de la nature
Une équipe de chercheurs du mont Sinaï a produit une structure cristalline à haute résolution d'une enzyme essentielle à la survie du SRAS-CoV-2, le virus qui cause le COVID-19. Cette découverte pourrait conduire à la conception de nouveaux antiviraux indispensables pour lutter contre les coronavirus actuels et futurs.
L'enzyme, connue sous le nom de nsp14, possède une région d'une importance cruciale connue sous le nom de domaine de l'ARN méthyltransférase, qui a échappé aux tentatives précédentes de la communauté scientifique pour caractériser sa structure cristalline tridimensionnelle. Un article décrivant le processus innovant a été publié dans l'édition en ligne du 8 septembre de Nature Structural &Molecular Biology .
"Être capable de visualiser la forme du domaine méthyltransférase de nsp14 à haute résolution nous donne un aperçu de la façon de concevoir de petites molécules qui s'intègrent dans son site actif et inhibent ainsi sa chimie essentielle", explique l'auteur principal Aneel Aggarwal, Ph.D. , professeur de sciences pharmacologiques à l'école de médecine Icahn du mont Sinaï. "Grâce à ces informations structurelles, et en collaboration avec des chimistes médicinaux et des virologues, nous pouvons désormais concevoir des inhibiteurs à petites molécules à ajouter à la famille des antiviraux qui vont de pair avec les vaccins pour combattre le SRAS-CoV-2."
Les antiviraux sur ordonnance qui ciblent les enzymes clés du SRAS-CoV-2 comprennent le nirmatrelvir pour la principale protéase (M Pro ) et molnupiravir et remdesivir pour l'enzyme ARN polymérase (nsp12). La recherche pour développer de nouveaux antiviraux ciblant différentes activités enzymatiques s'est accélérée dans les laboratoires du monde entier, et la découverte de Mount Sinai a considérablement contribué à cet effort.
"Une partie de ce qui motive notre travail", explique le Dr Aggarwal, "est la connaissance acquise grâce au traitement du VIH, à savoir que vous avez généralement besoin d'un cocktail d'inhibiteurs pour un impact maximal contre le virus."
L'équipe de Mount Sinai a en fait développé trois structures cristallines de nsp14, chacune avec des cofacteurs différents, à partir desquelles ils ont identifié le meilleur échafaudage pour la conception d'antiviraux pour inhiber l'activité de l'ARN méthyltransférase que l'enzyme active et dont le virus a besoin pour survivre. Selon leur schéma, l'antiviral prendrait la place du cofacteur naturel S-adénosylméthionine, empêchant ainsi la chimie de la méthyltransférase de se produire. Les structures cristallines que l'équipe a élucidées ont été mises à la disposition du public et serviront désormais de guides aux biochimistes et aux virologues du monde entier pour concevoir ces composés.
Rendre la découverte possible était la capacité des chercheurs à franchir un obstacle qui avait empêché d'autres dans le passé de créer des cristaux tridimensionnels du domaine nsp14 méthyltransférase. "Nous avons utilisé une approche connue sous le nom de cristallisation assistée par fusion", explique l'auteur principal Jithesh Kottur, Ph.D., boursier postdoctoral à Icahn Mount Sinai, cristallographe et biochimiste. "Il s'agit de fusionner l'enzyme avec une autre petite protéine qui l'aide à se cristalliser."
Le Dr Aggarwal, biologiste structurel de renommée internationale, souligne l'importance des travaux d'investigation en cours des chercheurs dans son domaine contre un virus qui a fait des millions de morts dans le monde. "Le virus évolue si rapidement qu'il peut développer une résistance aux antiviraux actuellement disponibles, c'est pourquoi nous devons continuer à en développer de nouveaux", observe-t-il. "En raison de la conservation de la séquence élevée de nsp14 à travers les coronavirus et leurs variantes (ce qui signifie qu'il ne mute pas beaucoup), notre étude aidera à la conception d'antiviraux à large spectre pour les épidémies de coronavirus présentes et futures." Une nouvelle étude découvre la structure tridimensionnelle de la machine de réplication du génome