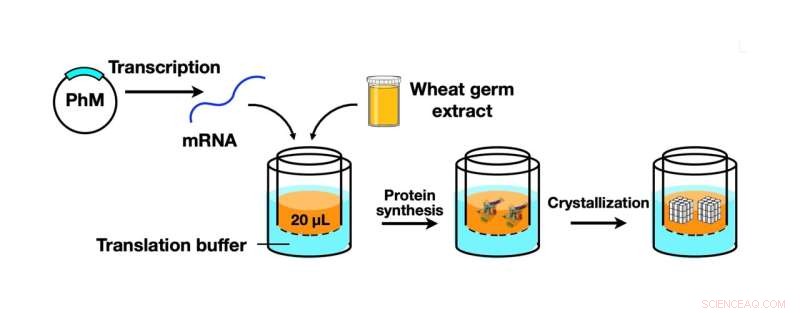
Illustration schématique du processus CFPC utilisant un kit de synthèse de protéines de germe de blé pour synthétiser le monomère de polyédrine (PhM) qui a ensuite été cristallisé en cristaux de polyèdres de taille nanométrique. Crédit :Prof. Takafumi Ueno
La nouvelle méthode de cristallisation des protéines sans cellule (CFPC) développée par Tokyo Tech comprend la cristallisation directe des protéines et constitue une avancée majeure dans le domaine de la biologie structurale. Cette technique permettra l'analyse de protéines instables qui ne pourraient pas être étudiées avec les méthodes conventionnelles. Leur analyse augmentera notre connaissance des processus et des fonctions cellulaires.
Alors que nous connaissons certains cristaux comme le sel et le sucre que nous utilisons dans notre vie quotidienne, il existe un autre ensemble de cristaux, caché à l'œil nu, qui est crucial pour notre biologie. Les cristaux de protéines microscopiques se trouvent dans les cellules vivantes et aident à soutenir des processus tels que l'activation du système immunitaire, le stockage et la protection des protéines.
Pour mieux comprendre la relation entre la structure et la fonction des cristaux de protéines, les scientifiques ont développé la méthode de cristallisation des protéines dans les cellules (ICPC), qui peut observer directement les cristaux de protéines dans les cellules vivantes, garantissant des cristaux de haute qualité sans avoir besoin de processus de purification ou de criblage complexe. méthodes. Cependant, malgré ses nombreux avantages, très peu de structures ont été rapportées car les cristaux formés dans les cellules vivantes n'avaient pas la taille et la qualité requises pour l'analyse. Ainsi, une équipe de chercheurs japonais, dirigée par le professeur Takafumi Ueno de Tokyo Tech, a cherché à développer une meilleure méthode. Et récemment, ils ont fait une percée.
Dans leur article publié dans Scientific Reports , l'équipe a signalé le développement d'une technique qui rendrait la cristallisation et l'analyse des protéines plus efficaces et efficientes. Cette technique, une méthode de cristallisation de protéines sans cellule (CFPC), était un hybride entre la cristallisation de protéines in vitro et l'ICPC, et permettait la formation rapide et directe de cristaux de protéines sans avoir besoin de méthodes compliquées de cristallisation et de purification.
Les images de microscopie électronique à balayage et les histogrammes de distribution de taille des cristaux de polyèdres (PhC) montrent différents points du processus CFPC dépendant du temps. Crédit :Prof. Takafumi Ueno
Pour en revenir à l'équipe menant l'étude actuelle (dont certains sont également membres du laboratoire d'Ueno), ils ont utilisé un kit de synthèse de protéines de germe de blé, qui est un outil de synthèse de monomère de polyhédrine, une protéine virale produite dans des cellules d'insectes par infection à cypovirus. Cette protéine a ensuite été cristallisée à l'aide de la nouvelle méthode CFPC, conduisant à la formation de cristaux de polyèdres (PhC) de taille nanométrique. L'équipe a pu terminer efficacement ce processus en six heures, en utilisant seulement 20 microlitres du mélange réactionnel.
Les images de microscopie électronique à balayage ont indiqué que les PhC avaient une excellente pureté, ce qui a permis la détermination de leur structure à une résolution aussi élevée que 1,95 Å (ou 1,95 angström). Pour explorer davantage les capacités de leur nouveau système, l'équipe a effectué l'analyse structurelle de la protéine d'inclusion cristalline A (CipA). Sa structure a été déterminée à une haute résolution de 2,11 Å, ce qui n'avait jamais été rapporté avant cette étude.
Ce travail est un grand pas en avant dans le domaine de la biologie structurale car la méthode qu'il propose permettra l'analyse de protéines instables et à faible rendement qui ne peuvent pas être étudiées par les méthodes conventionnelles. Cette technologie vise également à faciliter le développement de techniques avancées pour la cristallisation et l'analyse de protéines à petite échelle et rapides. "Les cristaux de protéines de haute qualité produits par notre méthode élargiront les horizons de la détermination structurelle et nous fourniront des informations utiles et sans précédent sur l'environnement complexe des cellules vivantes", déclare le professeur Ueno. Imprimante nano-3D intracellulaire :synthétiser des filaments stables à partir de cristaux de protéines intracellulaires