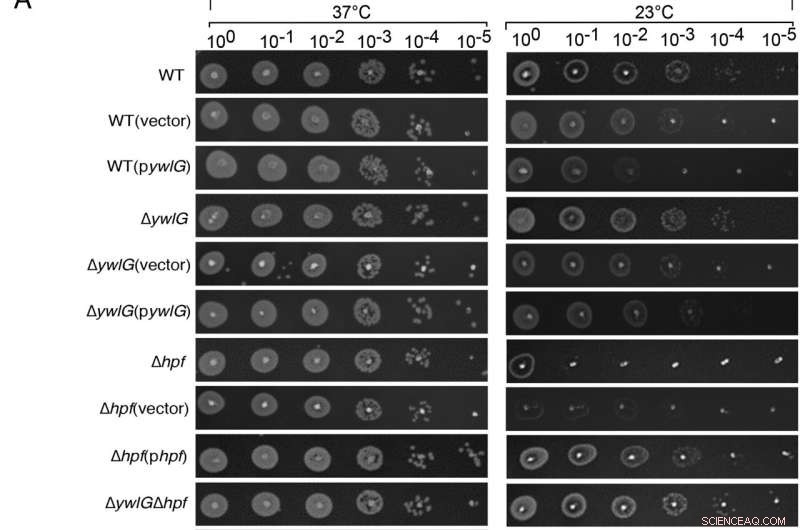
L'inactivation de ywlG supprime la sensibilité au froid d'un mutant Δhpf-null d'une manière dépendante du milieu. La complémentation avec ywlG et hpf codés par plasmide a confirmé la suppression médiée par YwlG et la réponse au froid dépendante de HPF. Des dosages ponctuels de dilution en série ont été effectués sur des plaques de gélose à base de bouillon de lysogénie (LB) ou (B) de bouillon de soja trypsique (TSB). Cellules à croissance exponentielle (OD600 =0,6) dans le TSB ont été ajustés à OD600 =0,2 après deux lavages en 1xPBS. Après des dilutions en série, 2 µL de chaque dilution ont été déposés sur les plaques de gélose. Les résultats ont été enregistrés après 24 h et 48 h d'incubation à 37 °C et 23 °C, respectivement. Les images sont représentatives de trois expériences indépendantes. Crédit :Actes de l'Académie nationale des sciences (2022). DOI :10.1073/pnas.2207257119
Les chercheurs de Northwestern Medicine ont découvert de nouveaux mécanismes de régulation qui favorisent la survie des bactéries, selon les résultats publiés dans les Proceedings of the National Academy of Sciences .
L'étude, dirigée par M.-N. Frances Yap, Ph.D., professeur agrégé de microbiologie-immunologie, pose également les bases de l'identification de nouvelles cibles thérapeutiques pour traiter les infections bactériennes.
L'hibernation des ribosomes est un mécanisme mis en œuvre par les bactéries et d'autres organismes, y compris les eucaryotes, pour assurer la survie à long terme. Les ribosomes hibernants 100S chez les bactéries sont constitués de deux complexes 70S reliés par une protéine facteur favorisant l'hibernation (HPF).
Ce complexe 100S a deux objectifs principaux :empêcher la dégradation de la machinerie de biosynthèse des protéines (ribosomes) et conserver l'énergie dans la cellule en arrêtant la traduction de l'ARNm.
Dans l'étude actuelle, l'équipe de Yap a utilisé la spectrométrie de masse pour étudier les interactions protéiques dans le Staphylococcus aureus résistant à la méthicilline, une bactérie communément connue pour provoquer des infections à staphylocoques. À partir de ces analyses, ils ont découvert que HPF interagit avec un partenaire de liaison précédemment non identifié situé à l'extérieur du ribosome, une protéine appelée YwlG.
De plus, en résolvant la structure atomique de YwlG, ils ont découvert que cette protéine est impliquée dans l'activité de la glutamate hydrogénase, qui est une voie métabolique essentielle nécessaire à la survie des bactéries.
"Dans des conditions normales, une fraction de la protéine YwlG est liée au HPF. En se liant ensemble, YwlG ne peut pas stimuler l'activité de la glutamate hydrogénase et HPF ne peut pas se lier au ribosome, c'est donc une" séquestration mutuelle "des deux protéines pour assurer la bonne quantité de Des complexes 100S et de la glutamate déshydrogénase cellulaire sont produits », a déclaré Yap.
Les résultats indiquent à la fois HPF et YwlG comme facteurs qui influencent la colonisation bactérienne et la gravité de l'infection. L'objectif final, selon Yap, est d'identifier un composé qui peut perturber la formation de ces complexes et, à son tour, inhiber la survie à long terme des bactéries.
"Un avantage clé est que la protéine similaire à HPF ou YwlG n'existe pas chez l'homme, vous pouvez donc développer un antibactérien ciblant HPF ou YwlG qui inhibe la croissance bactérienne mais ne nuit pas aux hôtes", a déclaré Yap. Les ribosomes hibernants aident les bactéries à survivre