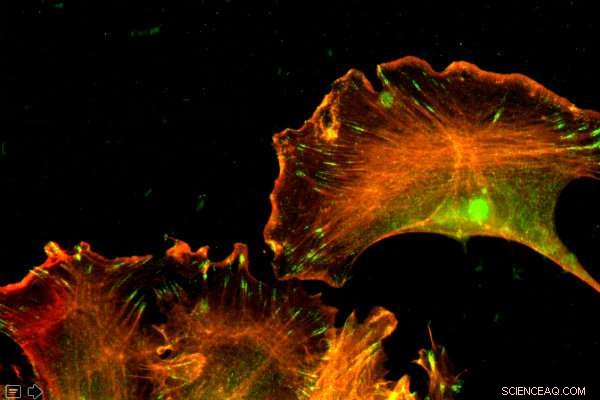
L'actine est une protéine abondante, présent dans chaque cellule. Les chercheurs de Penn Vet ont montré que les différences dans l'ordre des nucléotides - et non des acides aminés - régissaient les fonctions distinctes de deux formes d'actine. Crédit :Université de Pennsylvanie
Les humains possèdent six formes de la protéine actine, qui remplissent des fonctions essentielles dans le corps. Deux en particulier, -actine et -actine, sont presque identiques, ne différant que de quatre acides aminés. Pourtant, ces protéines quasi-jumelles remplissent des rôles distincts. Une question de longue date pour les biologistes a été, comment est-ce possible?
"C'est un mystère qui fait débat sur le terrain depuis 40 ans, " dit Anna Kashina, professeur de biochimie à l'École de médecine vétérinaire de l'Université de Pennsylvanie.
De nouvelles découvertes de Kashina et de ses collègues ont mis en évidence une réponse surprenante. Les différentes fonctions de ces protéines ne sont pas déterminées par leurs séquences d'acides aminés mais par leur code génétique.
"Nous aimons l'appeler le 'code silencieux, "", a déclaré Kashina. "Nos résultats montrent que les parties des gènes que nous considérons comme silencieuses codent en fait des informations fonctionnelles très importantes."
Les chercheurs ont découvert que ces différences "silencieuses" dans la séquence nucléotidique semblent influencer la densité des ribosomes, les machines moléculaires qui traduisent l'ARN en protéines. De telles différences peuvent permettre à chaque forme d'actine individuelle de jouer un rôle différent dans la cellule.
Kashina a co-écrit le travail, publié dans la revue eLife , avec Pavan Vedula de Penn Vet, Satoshi Kurosaka, Nicolae Adrien Leu, Junling Wang, Stephanie Sterling et Dawei Dong et Yuri I. Wolf et Svetlana A. Shabalina des National Institutes of Health.
L'actine est si omniprésente et essentielle qu'elle est connue comme une "protéine d'entretien". C'est la protéine la plus abondante dans la plupart des cellules, et ses différentes formes jouent des rôles lors de la migration cellulaire, contraction et développement musculaire. Pendant un temps, les scientifiques pensaient que les différentes formes étaient fonctionnellement redondantes, existant uniquement pour servir de sauvegarde au cas où un formulaire présenterait un défaut.
Plus récemment, les chercheurs ont compris que les formulaires ne sont pas redondants; certains se localisent dans différentes parties des cellules, certains sont incorporés dans différentes parties du cytosquelette. Et quand ces protéines sont trafiquées, les résultats sont également différents.
En cas de manque de β-actine, par exemple, les souris meurent à un stade précoce du développement embryonnaire. Mais les souris dépourvues de γ-actine, bien que généralement plus petit que la normale et sourd, peut survivre jusqu'à l'âge adulte.
Dans un rapport publié en 2010 dans Science, Le groupe de Kashina a fait un pas vers la compréhension de ce qui détermine ces différences. En regardant une modification de protéine qui n'existe normalement que dans la -actine, ils ont découvert que la raison pour laquelle il n'était pas également présent sur la -actine était due à des variations dans la séquence codante entre les deux gènes d'actine.
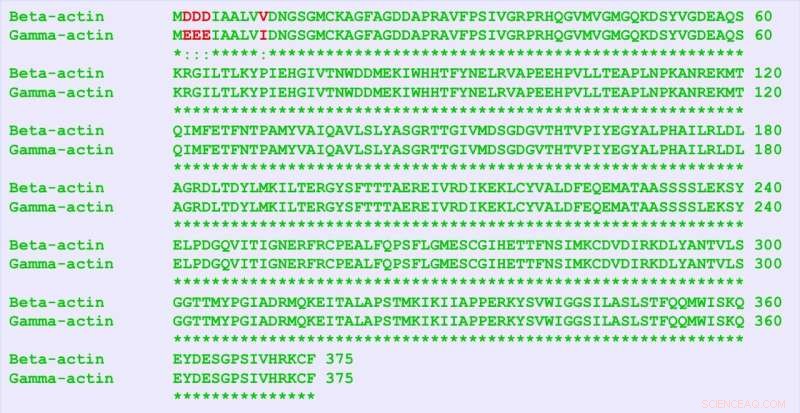
La -actine et la -actine sont des protéines presque identiques, ne différant que de quatre acides aminés (en rouge). Mais ils contiennent beaucoup plus de différences dans leur séquence nucléotidique, et ce "code silencieux" est responsable de fonctions distinctes des deux protéines, les chercheurs ont trouvé. Crédit :Université de Pennsylvanie
"Nous avons voulu construire là-dessus, " Kasina dit, " et a décidé de tester l'hypothèse, « Et si leurs différences fonctionnelles n'avaient rien à voir avec leur séquence d'acides aminés ? et si tout était dans les gènes ?'"
Les chercheurs ont profité de l'édition génétique de précision rendue possible par le système CRISPR/Cas-9. Alors que les deux isoformes d'actine ne diffèrent que de quatre acides aminés, leurs séquences codantes d'ARNm diffèrent de près de 13 pour cent en raison de différences de nucléotides "silencieuses" qui codent néanmoins pour les mêmes acides aminés. Apporter des modifications à seulement cinq nucléotides dans le gène de la -actine, ils ont pu le transformer de sorte que sa production d'acides aminés soit exactement la même que celle de la protéine γ-actine. Tout ce qui le distinguerait serait les substitutions silencieuses de nucléotides.
L'édition de gènes a fonctionné. Les souris avec ces modifications n'avaient pas de protéine β-actine. Mais contrairement aux véritables knock-outs de la β-actine, ils étaient complètement sains et viables, tout comme s'ils possédaient les proportions appropriées de protéines -actine et -actine. Ils ont survécu pour se reproduire et avaient en moyenne la même taille de portée que les animaux normaux.
Les chercheurs ont effectué la même expérience, modifier le gène de la -actine pour coder la protéine de la -actine, mais n'ont pu modifier la séquence codante que pour trois des quatre acides aminés. Toujours, les souris soumises à ce remplacement partiel sont également apparues normales et saines, malgré l'absence de protéine γ-actine.
Dans les expériences de suivi, L'équipe de Kashina a découvert que les protéines -actine fabriquées à partir du gène -actine modifié formaient un cytosquelette normal et permettaient à la cellule de migrer de manière normale.
"Si seulement la séquence nucléotidique est importante pour la fonction des protéines, alors les souris ne devraient pas se soucier de la protéine qu'elles ont, " dit Kashina. " Et les souris s'en fichaient. "
Trouver un mécanisme expliquant comment la séquence d'ADN pourrait influencer la fonction des protéines, les chercheurs ont découvert que la densité des ribosomes sur l'ARN -actine est plus de mille fois plus élevée que sur l'ARN -actine, et en effet, les six gènes d'actine présentaient des différences de densité des ribosomes.
"Cela suggère que la -actine pourrait se traduire en protéine peut-être mille fois plus rapidement que la γ-actine, " dit Kashina.
Et curieux de savoir à quel point ce phénomène pourrait être répandu, les chercheurs ont recherché des familles de protéines avec des membres presque identiques qui sont codés par différents gènes et qui présentaient des variations significatives de la densité des ribosomes au sein de la famille. Ils ont trouvé de nombreux groupes partagés entre les souris, poisson zèbre et génomes humains.
« Nous pensons que cette forme de régulation fonctionnelle est un phénomène mondial, " Kasina dit, et c'est celui que son laboratoire continuera d'étudier.