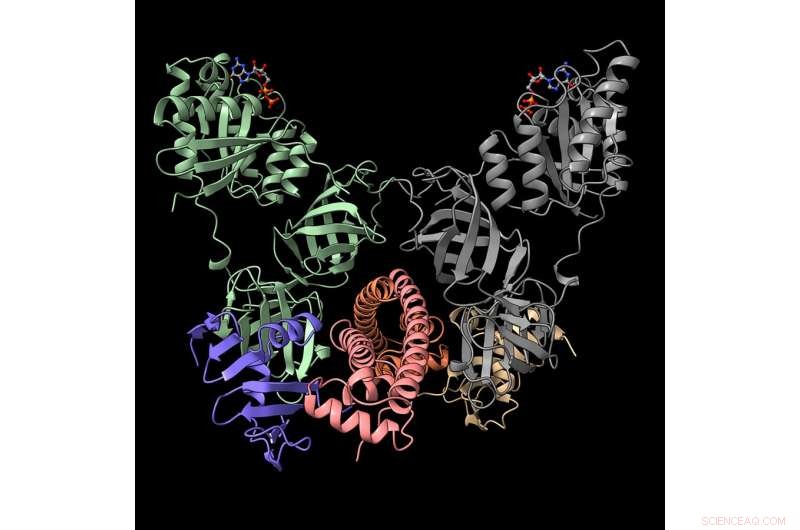
Les scientifiques d'Argonne ont déterminé la structure moléculaire de ce complexe protéique - une idée qui pourrait conduire à de nouvelles stratégies biomédicales pour vaincre les bactéries pathogènes qui causent des maladies infectieuses. Cette représentation montre le complexe neutralisé de la toxine CdiA (violet et beige) avec la protéine immunitaire CdiI (orange et rose) et le facteur d'élongation EF-Tu (gris et vert). Crédit :Karolina Michalska / Laboratoire national d'Argonne
Chaque fois que nous utilisons nos smartphones pour consulter les réseaux sociaux, nous sommes confrontés à des tonnes de bactéries sur les appareils, encore plus que sur les sièges de toilette, selon une étude de l'Université de l'Arizona. Ces bactéries peuvent avoir leur propre forme de réseau social qui, comme Facebook, permet aux créatures unicellulaires de s'attirer et de se repousser.
Cette idée découle de nouvelles recherches menées par des scientifiques du département américain de l'Énergie (DOE) qui ont déterminé les structures moléculaires d'un ensemble hautement spécialisé de protéines. Ces protéines sont utilisées par une souche de bactérie E. coli pour communiquer et défendre leur territoire.
Les travaux pourraient conduire à de nouvelles stratégies biomédicales pour vaincre les bactéries pathogènes qui causent des maladies infectieuses telles que la pneumonie et les maladies d'origine alimentaire. Il s'agit de la dernière avancée d'un groupe de scientifiques du laboratoire national d'Argonne du DOE; l'Université de Californie, Santa Barbara (UCSB); et l'Université de Californie, Irvine.
Le travail s'appuie sur la découverte de 2005 par des chercheurs de l'UCSB que les bactéries produisent des protéines toxiques, qu'ils peuvent transférer à leurs voisins par contact direct pour les tuer ou les contrôler, peut-être pour avoir un meilleur accès aux nutriments. Il ne se produit que dans les communautés microbiennes densément peuplées par le biais d'un processus appelé inhibition de la croissance dépendante du contact (CDI).
"Nous apprenons essentiellement comment les bactéries interagissent et communiquent, " a déclaré Andrzej Joachimiak, Argonne Distinguished Scientist au sein de la division Biosciences du laboratoire. "Nous avons des idées que nous essayons de résoudre, car les toxines peuvent avoir des activités différentes. Ils peuvent affecter différentes bactéries différemment. »
"Ces systèmes se trouvent non seulement dans le sol et les bactéries intestinales, mais aussi chez les pathogènes humains, " dit Joachimiak, qui est également chercheur principal au Computation Institute de l'Université de Chicago. "Certaines de ces toxines des systèmes CDI sont présentes dans Pseudomonas aeruginosa, par exemple, qui est impliqué dans les maladies pulmonaires.
Joachimiak et 10 co-auteurs ont publié leurs conclusions dans le 29 septembre, Numéro 2017 de la revue Recherche sur les acides nucléiques .
L'équipe d'Argonne a obtenu les structures moléculaires de protéines appartenant à un système en trois parties de la souche NC101 d'E. coli. Les trois parties sont constituées de la toxine CDI, sa protéine immunitaire et son facteur d'élongation. Le dernier, connu sous le nom EF-Tu, est une protéine qui joue un rôle clé dans la synthèse des protéines. Connaître les structures protéiques des trois parties aide les scientifiques à comprendre leur fonction.
La découverte de la protéine immunitaire a conduit les scientifiques à soupçonner que le but du système comprend non seulement la compétition mais aussi la signalisation, le processus par lequel les cellules bactériennes communiquent entre elles, ainsi que tuer et contrôler d'autres bactéries.
"Il n'y a vraiment que quelques molécules de la toxine qui pénètrent dans la cellule voisine, " a déclaré Karolina Michalska, cristallographe de protéines à Argonne et co-auteur principal de l'article. "Il est difficile d'estimer l'étendue réelle des dommages cellulaires. C'est pourquoi nous pensions que ce n'était pas censé tuer, mais plutôt de contrôler et de communiquer."
La toxine ne peut agir sur l'acide ribonucléique de transfert (ARNt) que dans des circonstances très spécifiques.
"Cette toxine particulière agit sur l'ARNt et il doit s'agir d'un ensemble très spécifique d'ARNt, " a déclaré Michalska. "C'est le premier cas où nous considérons le facteur d'allongement comme ce composant supplémentaire nécessaire au fonctionnement de la toxine."
L'équipe d'Argonne a collecté des données sur les structures des protéines à l'aide de la ligne de lumière du Centre de biologie structurale à l'Advanced Photon Source (APS), une installation utilisateur du ministère de l'Énergie du Bureau des sciences. L'APS est une source lumineuse de troisième génération, fournissant des rayons X extrêmement brillants qui permettent aux chercheurs d'explorer les réseaux de molécules dans les matériaux. A l'aide de cet outil, les chercheurs peuvent caractériser, ou identifier, protéines biologiques et inspecter les processus chimiques à l'échelle nanométrique (un milliardième de mètre).
L'équipe de recherche d'Argonne a également exploité l'installation de caractérisation avancée des protéines du laboratoire, qui offre les technologies les plus avancées du pays pour l'étude de nouvelles classes de protéines et de complexes protéiques.