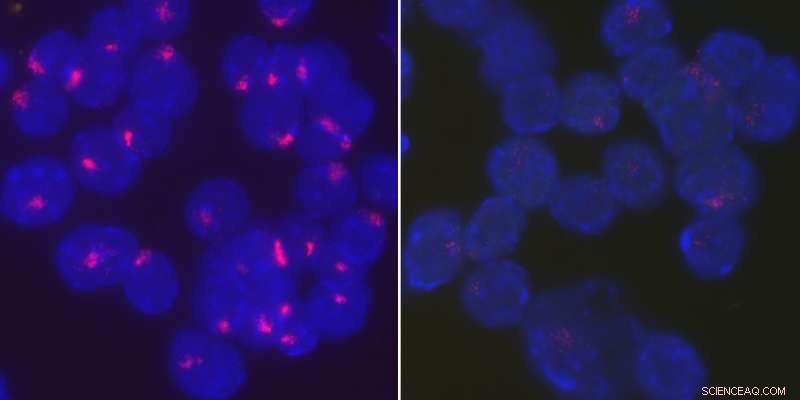
Les chercheurs ont découvert que la protéine YY1 ramène l'ARN Xist au chromosome X inactif pour maintenir l'inactivation du chromosome X dans les cellules B stimulées. Activé, les cellules B de type sauvage de souris femelles localisent étroitement l'ARN Xist au niveau de leurs chromosomes X inactifs (à gauche), tandis que l'ARN Xist se disperse dans tout le noyau lorsque YY1 est supprimé (à droite). Crédit :Université de Pennsylvanie
Les maladies auto-immunes ont tendance à frapper plus les femmes que les hommes et le fait d'avoir plusieurs chromosomes X pourrait en être la principale raison. Alors qu'un processus appelé inactivation du chromosome X sert à équilibrer le dosage des gènes entre les hommes et les femmes, certains gènes du chromosome « X inactif » des cellules immunitaires peuvent parfois échapper à ce processus, donner aux femmes une dose supplémentaire d'expression génique liée à l'immunité.
Dans une nouvelle étude, une équipe de l'Université de Pennsylvanie décrit comment l'inactivation du chromosome X est régulée dans les cellules B du système immunitaire lorsqu'elles se développent dans la moelle osseuse et lorsqu'elles rencontrent des antigènes. Leurs travaux éclairent une dynamique, mécanisme en deux étapes chez les femelles par lequel les cellules B dépourvues des marqueurs de l'inactivation du chromosome X retrouvent ces modifications lors de l'activation des cellules B, dans un processus impliquant le facteur de transcription YY1.
"Ce qui est remarquable, c'est que ce sont les cellules B qui fabriquent les anticorps et les auto-anticorps, ils sont donc vraiment cruciaux dans les réponses immunitaires protectrices et l'auto-immunité, " a déclaré Montserrat C. Anguera, professeur adjoint au Département des sciences biomédicales de la Penn's School of Veterinary Medicine et auteur principal de l'étude. "Une grande question qui demeure est, Pourquoi ces cellules immunitaires se préparent-elles à ce que ce chromosome soit régulé différemment et aussi, Si ces processus tournent mal, Comment cela mène-t-il à l'auto-immunité et à la perte de la tolérance de soi ? »
L'étude, Publié dans PLOS Génétique , était dirigé par Camille M. Syrett, un doctorant dans le laboratoire d'Anguera. Co-auteurs, représentant à la fois Penn Vet et Penn's Perelman School of Medicine, étaient Vishal Sinhava, Suchita Hodawadekar, Arpita Myles, Guanxiang Liang, Yue Zhang, Satabdi Nandi, Michael Cancro et Michael Atchison.
Dans une étude publiée l'année dernière dans la revue Actes de l'Académie nationale des sciences , Anguera et ses collègues ont trouvé que naïf, lymphocytes femelles non stimulés, les cellules B et T du système immunitaire, n'a pas réussi à inactiver complètement un chromosome X. La recherche a montré que c'était parce que Xist, un long transcrit d'ARN non codant bien connu pour initier et maintenir le processus d'inactivation du chromosome X, n'a pas réussi à se localiser sur le chromosome X inactif. Lorsque les cellules immunitaires ont été activées, ou prêt à répondre à l'infection, L'ARN Xist est réapparu au bon endroit.
"Nous avons vu que les cellules B inactivées n'ont pas ce nuage d'ARN, mais il revient à la stimulation, " a déclaré Syrett. "Nous étions vraiment intéressés à déterminer ce qui ramène l'ARN Xist."
À l'aide d'une molécule traqueuse fluorescente, l'équipe a commencé par suivre l'emplacement de Xist dans le développement des cellules B chez les souris femelles. Ils ont découvert que les précurseurs des cellules B, tels que les cellules souches hématopoïétiques et les progéniteurs lymphoïdes communs, avait des motifs clairs d'ARN Xist sur le chromosome X inactif. Mais, au fur et à mesure que ces précurseurs des cellules B ont suivi une voie de développement pour devenir des cellules B, Xist RNA a d'abord semblé disparaître, puis réapparait, mais seulement sous forme de piqûres diffuses à travers le noyau au lieu d'être localisées sur le X inactif.
En outre, étiquettes de petites molécules appelées modifications de l'hétérochromatine, qui sont connus pour maintenir la répression des gènes pendant l'inactivation du chromosome X, disparu au cours du développement des cellules B.
"Nous avons pu voir ces changements vraiment inhabituels au niveau de la chromatine se produire dans le développement des cellules B féminines, " a déclaré Anguera.
Pour savoir comment le Xist est revenu au X inactif lors de l'activation des cellules B, comme ils l'avaient montré dans l'article de PNAS de l'année dernière, les chercheurs ont suivi l'ARN Xist dans les cellules B en culture. Ils ont constaté que la réapparition s'est déroulée en deux phases distinctes :entre quatre et 16 heures après la stimulation des cellules, les taches d'ARN Xist ont commencé à apparaître. Et entre 16 et 30 heures après la stimulation, Xist ARN concentré exclusivement sur le chromosome X inactif. Les modifications de l'hétérochromatine semblent augmenter et se localiser également sur le X inactif dans cette deuxième phase.
L'étude précédente de l'équipe avait indiqué que la protéine YY1 jouait un rôle dans le retour de Xist dans les cellules B activées, ils ont donc commencé à l'examiner de plus près dans ce travail. Atchison, un leader dans les études de YY1 dans le développement des cellules B, a pu apporter son expertise pour étudier le rôle de la protéine dans l'inactivation du chromosome X.
Lorsque les chercheurs ont examiné les cellules B de souris dépourvues de YY1, ils ont vu des niveaux considérablement réduits de marques d'hétérochromatine ainsi qu'une localisation moindre de l'ARN Xist sur le X inactif.
L'équipe a également observé des preuves que YY1 influençait l'expression des gènes du chromosome X. Lorsqu'ils ont supprimé YY1 des cellules mâles et femelles et comparé les gènes exprimés de manière différentielle sur le chromosome X, ils en ont trouvé 68 qui étaient spécifiques aux femmes, un qui était spécifique aux hommes et 11 qui ont été partagés.
Sur les 68 gènes spécifiques aux femmes, beaucoup étaient liés à l'immunité, et au moins deux sont connus pour être surexprimés dans les cellules B femelles humaines par rapport aux cellules B mâles.
Une autre série d'expériences a identifié la zone de YY1 avec une activité de liaison à l'ADN comme domaine clé de cette protéine impliquée dans l'apport de l'ARN Xist au X inactif.
"Il semble agir comme une attache, réunir l'ARN Xist avec l'ADN du chromosome X inactif, " a déclaré Anguera.
Elle et ses collègues exploreront plus avant le rôle de YY1, en utilisant des échantillons cliniques ainsi que des modèles murins, d'examiner la protéine dans des maladies comme le lupus pour approfondir leur compréhension de la façon dont l'auto-immunité pourrait résulter de la « fuite » des gènes immunitaires de l'inactivation du chromosome X.
"Si vous voulez développer une thérapie pour les maladies auto-immunes, l'idée est, Comment pouvons-nous amener Xist sur le chromosome X inactif et le maintenir là afin de maintenir une compensation de dose dans ces cellules B ? », a déclaré Anguera. « YY1 ressemble certainement à une cible vraiment prometteuse. »