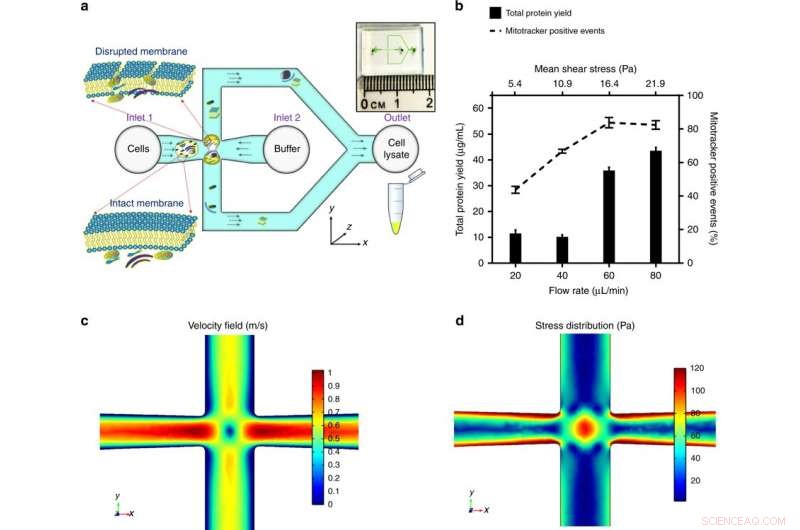
a) Les cellules sont introduites dans la jonction transversale du microcanal. Le stress appliqué sur la cellule est optimisé pour perturber la membrane cellulaire et libérer les composants subcellulaires, tout en maintenant l'intégrité des mitochondries. La vue d'ensemble de la puce microfluidique est montrée dans l'encart. b) La contrainte moyenne appliquée, modulé en contrôlant le débit volumétrique pour une géométrie de canal donnée, a été optimisé par le rendement maximal en protéines (une indication de la quantité du contenu subcellulaire extrait) et le nombre maximal d'événements positifs du mitotracker (une caractéristique des mitochondries fonctionnelles). Les résultats ont été obtenus par déchiquetage de cellules HEK293 (cellules rénales embryonnaires, 106 cellules/mL) par une plage de contrainte de cisaillement et tracée comme moyenne ± SD (n = 3 expériences indépendantes). Un modèle de simulation par éléments finis a été établi par COMSOL Multiphysics® pour illustrer l'écoulement fluidique à la jonction transversale. Donner un débit volumétrique à 60 μl/min, c) illustre le profil de vitesse et le point de stagnation au centre (où la vitesse d'écoulement est nulle), et d) illustre la distribution des contraintes et les champs d'écoulement d'extension autour du point de stagnation, ce qui contribue de manière significative à la déformation et à la rupture des cellules. Crédit :Microsystèmes &Nano-ingénierie, doi :https://doi.org/10.1038/s41378-018-0037-y.
Les mitochondries sont dynamiques, organites intracellulaires bioénergétiques, responsable de la production d'énergie via la production d'ATP pendant la respiration. Ils sont impliqués dans des tâches métaboliques cellulaires clés qui régulent les réponses physiologiques vitales des cellules, y compris la signalisation cellulaire, différenciation cellulaire et mort cellulaire. Les mitochondries défectueuses sont liées à plusieurs maladies génétiques humaines critiques, y compris les troubles neurodégénératifs, cancer et maladies cardiovasculaires.
La caractérisation détaillée des mitochondries fonctionnelles reste relativement inexplorée en raison d'un manque de méthodes efficaces d'extraction des organites. Par exemple, le processus d'extraction doit maintenir une fonctionnalité suffisante de l'organite ex vivo pour éclairer leurs fonctions cytosoliques en présence de cytosquelette et d'autres organites subcellulaires. Étant donné que les mitochondries se développent dans un réseau réticulaire complexe au sein des cellules pour subir des alternances structurelles, leur caractérisation intracellulaire est encore compliquée. Par conséquent, l'analyse in vitro des mitochondries reste la méthode dominante, extraire séparément et comprendre les propriétés intrinsèques des mitochondries, sans l'interférence d'autres organites subcellulaires.
Dans une étude récente, maintenant publié dans Microsystèmes et nano-ingénierie , Habibur Rahman et ses collègues du Département de génie biomédical ont exploré la possibilité de contrôler le stress hydrodynamique pour une extraction mitochondriale efficace. Pour ça, ils ont utilisé une géométrie microfluidique à jonction croisée à l'échelle microscopique pour perturber sélectivement la membrane cellulaire tout en garantissant l'intégrité de la membrane mitochondriale.
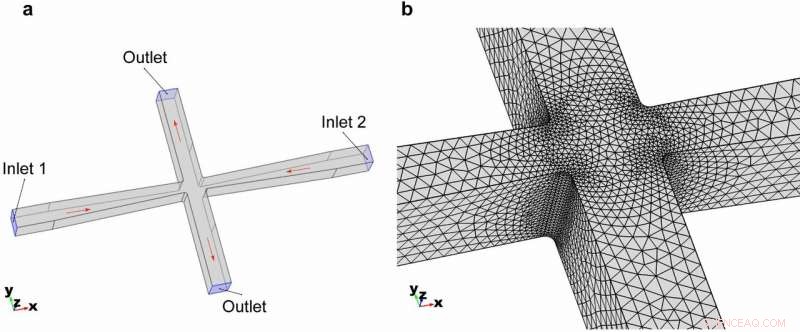
Géométrie 3D du canal microfluidique à fentes croisées. (a) Géométrie globale et conditions aux limites du modèle. (b) Maillage des éléments zoomés dans la région des fentes croisées. Crédit :Microsystèmes &Nano-ingénierie, doi :https://doi.org/10.1038/s41378-018-0037-y
Les progrès de la microfluidique ont démontré les avantages des procédures de laboratoire sur puce avec une taille d'échantillon considérablement réduite et une reproductibilité expérimentale accrue. Le stress hydrodynamique produit dans les puces microfluidiques peut être utilisé pour ouvrir les membranes cellulaires ou nucléaires de manière transitoire pendant la livraison de gènes intracellulaires. Le potentiel de telles techniques a rarement été examiné pour l'extraction d'organites subcellulaires, car les géométries contraintes des microcanaux peuvent provoquer le colmatage des composants subcellulaires dans les micromachines.
Les auteurs ont optimisé les conditions expérimentales de fonctionnement sur la base d'études antérieures pour déchiqueter efficacement les membranes cellulaires tout en conservant les mitochondries intactes dans les lignées cellulaires de mammifères modèles. Les lignées cellulaires modèles d'intérêt étaient des cellules rénales embryonnaires humaines (HEK293), cellules musculaires de souris (C2C12) et cellules de neuroblastome (SH-SY5Y).
Dans le principe de fonctionnement du déchiqueteur de cellules à micro-échelle proposé, les scientifiques ont mesuré la différence de module d'élasticité entre la membrane mitochondriale et la membrane cellulaire pour perturber la cellule tout en conservant la membrane mitochondriale. Un niveau de stress accru dans le système pourrait perturber les membranes cellulaires avec des modules d'élasticité plus élevés (comme on le voit avec la lignée cellulaire de neuroblastome). L'étude a comparé le rendement en protéines et la concentration de mitochondries fonctionnelles extraites à l'aide de la méthode proposée par rapport aux kits disponibles dans le commerce pour une gamme de concentrations cellulaires.
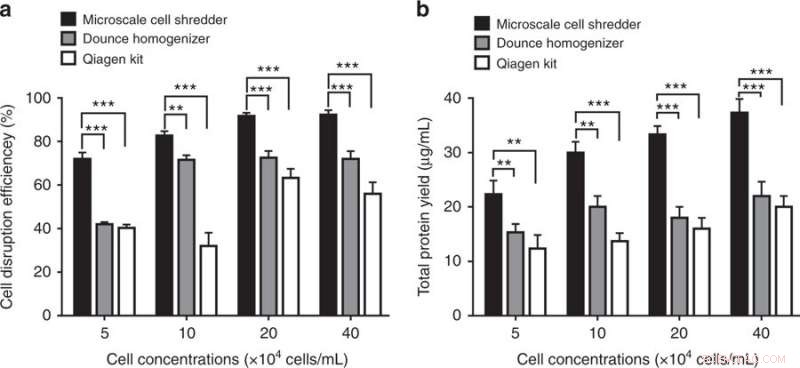
Rupture cellulaire et efficacité d'extraction des protéines à l'aide du déchiqueteur de cellules à micro-échelle, l'homogénéisateur Dounce et le kit d'isolement des mitochondries Qiagen. a) Efficacité de la rupture cellulaire, déterminé par la fraction de cellules rompues par rapport au nombre total de cellules intactes, a été quantifié à différentes concentrations cellulaires. b) Après les étapes de centrifugation, le rendement total en protéines a été déterminé en conséquence. Ces expériences ont été menées en utilisant des cellules HEK293. Les résultats ont été tracés sous forme de moyenne ± SD (n = 3 expériences indépendantes, **P < 0,01, ***P < 0,001). Crédit :Microsystèmes &Nano-ingénierie, doi :https://doi.org/10.1038/s41378-018-0037-y.
Les résultats ont montré que la méthode de broyage de cellules à micro-échelle proposée était plus efficace que les kits commerciaux en produisant environ 40 % de mitochondries fonctionnelles en plus. Les scientifiques ont pu préserver l'intégrité structurelle des organites extraits même à de faibles concentrations cellulaires. La méthode pourrait traiter rapidement une quantité limitée d'échantillons (200 µl).
Les résultats détaillés étaient une première démonstration d'étude de l'extraction de mitochondries intactes et fonctionnelles à l'aide d'un stress hydrodynamique à micro-échelle. La possibilité de traiter une faible concentration et une petite taille d'échantillon est favorable pour les investigations cliniques de la maladie mitochondriale. Pour tester la contrainte exercée par la jonction transversale conçue, ils ont d'abord utilisé un modèle de simulation COMSOL Multiphysics. Après, Rahman et al. déterminé expérimentalement le débit volumétrique pour trois lignées cellulaires modèles. Au cours de la rupture expérimentale de la membrane cellulaire, sous contrainte de cisaillement moyenne (16,4 Pa, pour un débit de 60 µL/min), les organites subcellulaires ont été libérés et détectés avec une augmentation des signaux positifs mitochondriaux.
Les scientifiques ont comparé la capacité du déchiqueteur de cellules miniaturisé à celle de deux kits commerciaux :l'homogénéisateur Dounce (méthode mécanique de rupture cellulaire) et le kit d'isolement des mitochondries Qproteome (méthode chimique de rupture cellulaire) pour extraire les mitochondries. Pour déterminer le nombre de mitochondries fonctionnelles extraites, les scientifiques ont utilisé MitoTracker, un colorant fluorescent qui colore les mitochondries lors de l'analyse par cytométrie en flux. Les résultats ont montré que le broyeur de cellules à micro-échelle était capable d'extraire 40 % de mitochondries fonctionnelles en plus par rapport aux kits commerciaux pour les cellules HEK 293 et C2C12.
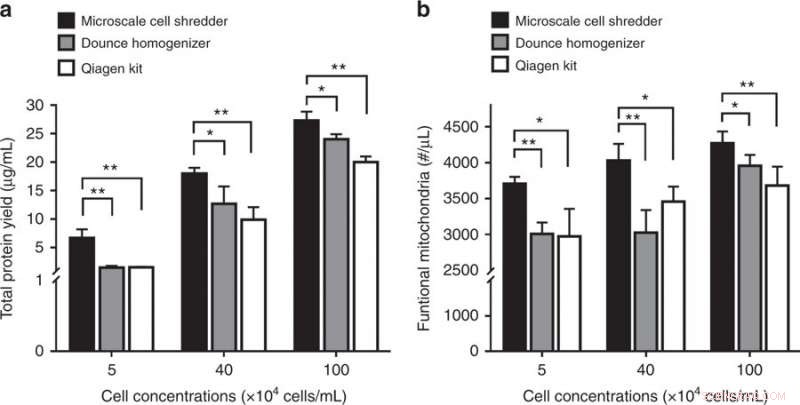
Perturbation des cellules de neuroblastome (SH-SY5Y) et extraction mitochondriale subséquente. a Rendement total en protéines et b concentrations de mitochondries fonctionnelles obtenues à partir des trois méthodes d'extraction. Les résultats ont été tracés sous forme de moyenne ± SD (n = 3 expériences indépendantes, *P < 0,05, **P < 0,01). Crédit :Microsystèmes &Nano-ingénierie, doi :https://doi.org/10.1038/s41378-018-0037-y.
Rahman et al. a mené le test de citrate synthase pour déterminer l'intégrité mitochondriale par l'activité enzymatique des mitochondries endommagées. Comme avant, par rapport aux kits commerciaux, l'intégrité mitochondriale était plus élevée pour celles extraites à l'aide du broyeur à micro-échelle dans les cellules HEK293 et C2C12.
L'étude a démontré l'importance de la rigidité membranaire en validant le concept proposé pour perturber les membranes cellulaires du neuroblastome (SH-SY5Y). Étant donné que la membrane cellulaire SH-SY5Y avait un module d'élasticité plus élevé que les lignées cellulaires HEK293 et C2C12, les scientifiques ont dû optimiser le débit volumétrique dans le broyeur à micro-échelle pour perturber efficacement les membranes cellulaires SH-SY5Y. De nouveau, par rapport aux extractions en kit du commerce, l'utilisation de la méthode proposée a permis d'obtenir une concentration significativement plus élevée de protéines et de mitochondries fonctionnelles pour la lignée cellulaire d'intérêt.

Une section de rétrécissement est incluse dans la conception du canal du déchiqueteur de cellules à micro-échelle pour garantir que les cellules sont focalisées latéralement au centre du flux d'écoulement dans le bioréacteur microfluidique. Crédit :Microsystèmes &Nano-ingénierie, doi :https://doi.org/10.1038/s41378-018-0037-y
De cette façon, Rahman et al. ont étudié la possibilité de perturber la membrane cellulaire pour conserver l'intégrité des membranes mitochondriales dans diverses lignées cellulaires modèles de mammifères. Ils ont déterminé la contrainte d'extension optimale et le débit à l'intérieur d'un bioréacteur à section transversale microfluidique, basé sur le module de Young de la lignée cellulaire modèle d'intérêt. Lors de la conception du canal, les scientifiques ont inclus une section de rétrécissement dans le bioréacteur microfluidique fabriqué par lithographie douce.
Le broyeur de cellules microfluidique proposé a démontré une capacité supérieure pour extraire des mitochondries fonctionnelles et des protéines en contrôlant pour la première fois le stress hydrodynamique, par rapport aux kits d'extraction d'organites cellulaires disponibles dans le commerce. Les expériences étaient réalisables même avec des quantités infimes d'échantillons (volume de 200 µl, contenant 10 4 cellules/mL) pour des applications cliniques potentielles. Rahman et al. ont pu reproduire fidèlement le protocole sur trois lignées cellulaires. Le travail expérimental peut être traduit en milieu clinique pour comprendre en profondeur les troubles liés à la dysfonction mitochondriale.
© 2019 Réseau Science X