En science, vous pouvez faire des expériences avec des composés hydratés et anhydres. La principale différence entre les composés hydratés et les composés anhydres est la présence de molécules d'eau. Un composé hydraté contient des molécules d'eau, mais un composé anhydre n'en contient pas.
Propriétés du composé hydraté
Un composé hydraté (un hydrate) est un composé chimique avec de l'eau dans sa structure. Par exemple, les sels hydratés contiennent de l'eau dans leurs cristaux. Les hydrates se forment naturellement lorsque les composés ioniques sont exposés à l'air et se lient aux molécules d'eau. Plus précisément, la liaison est formée entre le cation de la molécule et la molécule d'eau. L'eau qui reste est généralement connue sous le nom d'eau d'hydratation ou d'eau de cristallisation. La plupart des hydrates sont stables à température ambiante. Cependant, certains renvoient involontairement de l'eau dans l'atmosphère. Ces hydrates sont connus sous le nom d'efflorescent.
Propriétés du composé anhydre
Un composé anhydre (un anhydrate) est un composé sans eau dans sa structure. Une fois que l'eau est retirée d'un hydrate, elle devient un anhydrate. Les molécules d'eau sont éliminées par aspiration ou chauffage du composé à une température élevée. Par exemple, un sel anhydre a fait chasser l'eau de ses cristaux. Un composé anhydre provenant d'un hydrate est généralement très soluble dans l'eau et, lorsqu'il est dissous dans l'eau, il aura une couleur similaire à celle de l'hydrate d'origine, même s'il a changé de couleur en se transformant de l'hydrate en composé anhydre.
Exemples de Hydrates
Des exemples d'hydrates sont le gypse (couramment utilisé dans la fabrication de panneaux muraux, de ciment et de plâtre de Paris), le borax (utilisé dans de nombreux produits cosmétiques, de nettoyage et de lessive) et le sel d'Epsom (utilisé comme remède naturel et exfoliant). Les hydrates sont souvent utilisés dans les produits de soins de la peau pour infuser l'humidité dans le corps. Le monde contient de nombreux hydrates de gaz, des solides cristallins dans lesquels les molécules de gaz sont enfermées dans des structures constituées de molécules d'eau. Ceux-ci se forment à partir de températures très basses et de hautes pressions. Ils sont mélangés à des sédiments et se trouvent principalement dans les profondeurs de l'océan et dans les régions arctiques.
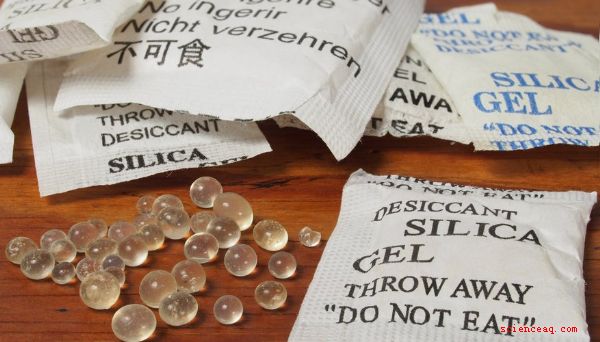
Exemples d'anhydrates
Les anhydrates, également connus sous le nom de déshydratants, éliminent l'eau, ils sont donc souvent utilisés dans les agents de séchage, comme le papier des produits. Le gel de silice est l'un des anhydrates les plus couramment utilisés. Un paquet de gel de silice est conservé à l'intérieur des sacs à main finis et d'autres produits pour absorber l'eau, en gardant la zone environnante sèche et en empêchant la croissance des moisissures. Les anhydrates peuvent également retenir l'humidité dans les aliments et les produits du tabac lorsqu'ils sont sous forme humectante.