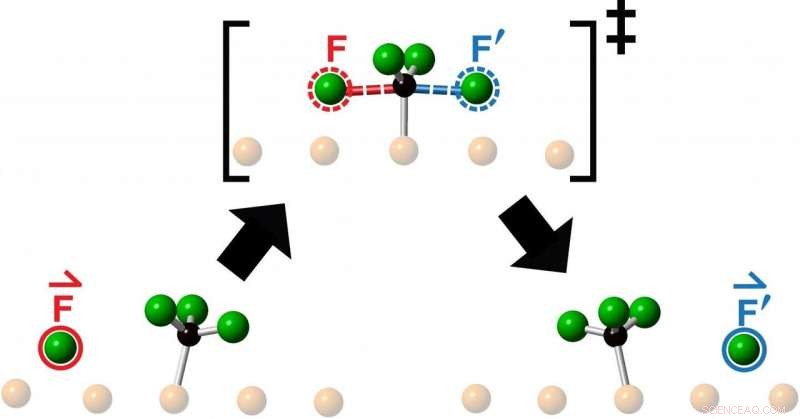
Interprétation d'un artiste de la barrière énergétique qu'un atome de fluor réactif doit franchir lorsqu'il entre en collision avec une molécule de fluorométhyle en route pour former un produit à la suite d'une réaction chimique. Des chercheurs de l'Université de Toronto ont observé l'éjection colinéaire « knock-on » du produit de réaction (entouré de bleu) dans le prolongement de la direction de la molécule de réactif entrante (entourée de rouge). Crédit :Lydie Leung
Recherche par une équipe de chimistes de l'Université de Toronto, dirigé par le chercheur lauréat du prix Nobel John Polanyi, apporte un nouvel éclairage sur le comportement des molécules lorsqu'elles entrent en collision et échangent des atomes au cours d'une réaction chimique. La découverte jette le doute sur un modèle théorique vieux de 90 ans du comportement de "l'état de transition", intermédiaire entre les réactifs et les produits dans les réactions chimiques, ouvrir un nouveau champ de recherche.
Les chercheurs ont étudié les collisions obtenues en lançant un atome de fluor au centre d'une molécule de fluorométhyle - composée d'un atome de carbone et de trois atomes de fluor - et ont observé la réaction résultante en utilisant la microscopie à effet tunnel. Ce qu'ils ont vu après chaque collision était l'éjection d'un nouvel atome de fluor se déplaçant colinéairement le long de la poursuite de la direction d'approche de l'atome de fluor entrant.
"Les chimistes lancent des molécules sur d'autres molécules tout le temps pour voir ce qui se passe ou dans l'espoir de faire quelque chose de nouveau, " dit Polanyi, Professeur d'université au Département de chimie de la Faculté des arts et des sciences de l'Université de Toronto et auteur principal d'une étude publiée ce mois-ci dans Chimie des communications . "Nous avons découvert que viser une molécule réactive au centre d'une molécule cible, limite le mouvement du produit émergent à une seule ligne, comme si le produit avait été directement 'enfoncé'. L'observation surprenante que le produit de réaction émerge en ligne droite, se déplaçant dans la même direction que l'atome de réactif entrant, suggère que les mouvements qui conduisent à la réaction ressemblent à un simple transfert de quantité de mouvement.
« La conservation de la quantité de mouvement linéaire que nous observons ici suggère un « état de transition » de courte durée, plutôt que l'opinion précédente selon laquelle il y a suffisamment de temps pour la randomisation du mouvement. Newton le ferait, Je pense, ont été heureux que la nature permette à un simple événement d'entraînement de décrire quelque chose d'aussi complexe qu'une réaction chimique, " dit Polanyi.

Matthew Timm, étudiant diplômé de l'Université de Toronto, prépare un microscope à effet tunnel pour une expérience contrôlant le résultat d'une réaction chimique en sélectionnant le paramètre d'impact des collisions moléculaires. Crédit :Diana Tyszko
L'équipe, qui comprenait l'associée de recherche principale Lydie Leung, étudiant diplômé Matthew Timm et Ph.D. diplômé Kelvin Anggara, avait précédemment établi les moyens de contrôler si une molécule lancée vers une autre entre en collision frontale avec sa cible ou manque d'une quantité choisie - une quantité connue sous le nom de paramètre d'impact. Plus le paramètre d'impact est élevé, plus la distance à laquelle la molécule entrante manque la molécule cible est grande. Pour le nouveau travail, les chercheurs ont utilisé un paramètre d'impact de zéro pour provoquer une collision frontale.
"Nous appelons ce nouveau type de réaction chimique unidimensionnelle « knock-on », puisque nous constatons que le produit est renversé dans le prolongement de la direction d'approche du réactif, " dit Polanyi. " Les mouvements ressemblent au choc des billes d'acier d'un berceau de Newton. Les billes d'acier du berceau ne se croisent pas, mais transférer efficacement l'élan le long d'une seule ligne.
"De la même manière, nos réactions d'entraînement transfèrent de l'énergie le long de rangées de molécules, favorisant ainsi une réaction en chaîne. Cette conservation de l'énergie de réaction dans la chimie d'entraînement pourrait être utile alors que le monde évolue vers la conservation de l'énergie. Pour l'instant, il sert d'exemple de réaction chimique dans sa forme la plus simple."
On sait depuis plus d'un siècle qu'il existe une barrière énergétique que les réactifs chimiques doivent traverser pour former des produits de réaction. Un état de transition sous tension existe brièvement au sommet de la barrière dans une configuration critique - pas d'état de transition, pas de réaction.
Polanyi dit que l'observation du « knock-on » colinéaire donne un aperçu du complexe de collision réactif, qui dure environ un million-millionième de seconde. "Nos résultats nous indiquent clairement que l'état de transition au sommet de la barrière énergétique dure si peu de temps qu'il ne peut pas complètement brouiller son élan. Au lieu de cela, il se souvient de la direction d'où venait l'atome de fluor attaquant."
Dans les années 1930, les chimistes ont commencé à calculer la probabilité de former un état de transition en supposant qu'il brouille son énergie, comme une molécule chaude. Même s'il s'agissait d'une hypothèse, elle est apparue bien établie et a donné naissance à la "théorie de l'état de transition" statistique des vitesses de réaction. C'est toujours la méthode privilégiée pour calculer les vitesses de réaction.
"Maintenant, avec la possibilité d'observer les réactifs et les produits au niveau moléculaire, on peut voir précisément comment les réactifs s'approchent et par la suite comment les produits se séparent, " dit Polanyi. " Mais cela va à l'encontre du modèle statistique classique vieux de 90 ans. Si l'énergie et la quantité de mouvement étaient aléatoires dans l'état de transition chaud, les produits ne présenteraient pas une mémoire claire de la direction d'approche des réactifs. La randomisation de l'énergie fonctionnerait pour effacer cette mémoire."
Les chercheurs affirment que le mouvement directionnel observé des produits de réaction favorise un modèle déterministe de l'état de transition pour remplacer le modèle statistique de longue date. En outre, la dynamique de réaction observée permet de transmettre l'énergie du réactif dans des collisions colinéaires successives.