Respiration chez les Actinomycètes et architecture globale de l'appareil respiratoire mycobactérien CIII2CIV2SOD2. A) La chaîne de transfert d'électrons respiratoire chez les Actinomycètes (à gauche) et les 5 principales variantes de la voie du cytochrome c procaryote avec les schémas d'organisation dans les organismes représentatifs (à droite). La voie du cytochrome c de M. smegmas a son cytochrome c fusionné avec le complexe III pour former un complexe III de type bcc qui interagit avec le complexe IV de type aa3 pour s'assembler en un supercomplexe CIII-CIV. MK =ménaquinone/ménaquinol. B) Toute l'architecture du Supercomplexe respiratoire CIII-CIV de type bcc-aa3 de M. smegmatis. La carte cryo-EM du supercomplexe montre une forme linéaire dimérisée 2 fois de CIV1-CIII2-CIV1 avec des dimensions 200 x 70 x 120 Å. CIII est vu en orange, CIV est en magenta et les facteurs d'association PRSAF1 en vert, LpqE en bleu et SOD en gris. C) Représentation de bande dessinée de la vue latérale du supercomplexe (en haut) et une vue en coupe (en bas). Le MK est présenté sous forme de sphères solides vert vif et les phospholipides sous forme de bâtonnets jaunes. Dans la vue en coupe du bas, les limites du CIII, Le CIV et le facteur d'association PRSAF1 sont représentés par des lignes pointillées en couleur (orange pour CIII, magenta pour CIV et vert pour PRSAF1). Crédit: Science , doi:10.1126/science.aat8923.
Dans une étude récente menée par Hongri Gong et ses collègues, un supercomplexe respiratoire a été isolé de la bactérie Mycobacterium smegmatis, et sa structure a été visualisée à une résolution de 3,5 Å en utilisant la cryomicroscopie électronique (cryo-EM). La bactérie est une proche parente de M. tuberculosis et un modèle populaire utilisé pour étudier de nombreuses autres espèces bactériennes. La structure détaillée a révélé comment les électrons ont été transférés dans la cellule dans un processus inédit.
Typiquement, l'énergie chimique pour synthétiser l'adénosine triphosphate (ATP) et alimenter les réactions cellulaires est extraite lors de la respiration cellulaire en couplant l'oxydation d'une source d'énergie (sucres, acides gras et acides aminés) et la réduction d'un accepteur d'électrons (oxygène, soufre, nitrate et sulfate). Dans la respiration cellulaire aérobie, l'énergie est extraite des donneurs d'électrons vers l'accepteur terminal, oxygène, via la chaîne de transport d'électrons (ETC) pour créer un gradient de protons transmembranaire connu sous le nom de force motrice de protons (PMF) qui entraîne la synthèse d'ATP. Les nouveaux résultats maintenant publiés dans Science révèlent un lien direct pour le transfert d'électrons entre les enzymes pour représenter un nouveau mode de catalyse de la chaîne respiratoire.
Les quinones et les cytochromes sont deux types de porteurs d'électrons dans les ETC utilisés pour transporter des électrons vers et depuis de grandes structures macromoléculaires incrustées dans la membrane. Quatre oxydoréductases membranaires sont impliquées dans la chaîne respiratoire mitochondriale pour le transfert d'électrons. Ceux-ci incluent le complexe I (NADH:ubiquinone oxydoréductase, CI), complexe II (succinate :ubiquinone oxydoréductase, CII), complexe III (bc
L'architecture du supercomplexe dans son intégralité :La représentation du dessin animé montre la ménaquinone/ménaquinol (MK) dans des sphères solides de couleur vert vif et des phospholipides sous forme de bâtonnets jaunes. Crédit: Science , doi:10.1126/science.aat8923
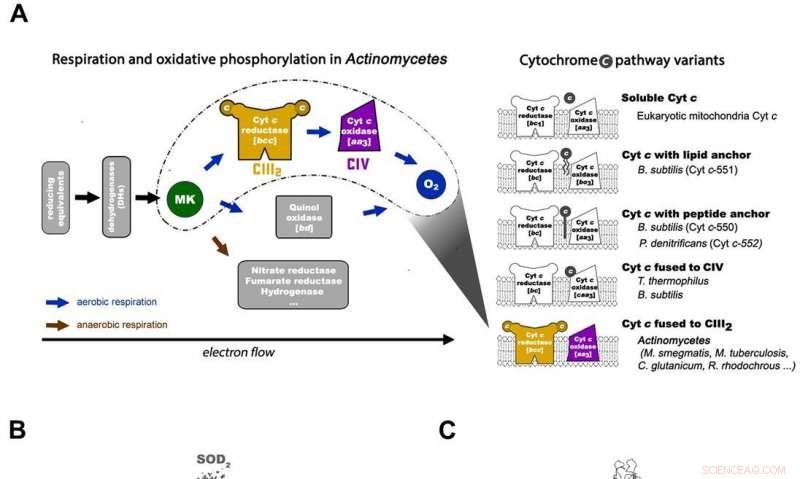
Dans la chaîne respiratoire procaryote, la situation est plus compliquée. Une voie complète du flux d'électrons n'a pas encore été déterminée dans le type de cellule en raison de sa complexité. Il est donc nécessaire de comprendre la structure complète d'un "supercomplexe" impliqué lors du transfert d'électrons bactérien pour faciliter l'objectif. Dans l'étude, les chercheurs ont extrait et purifié le complexe de M. smegmatis pour visualiser l'architecture en utilisant la cryomicroscopie électronique (cryo-EM) à une résolution de 3,5 Å. La structure a fourni des informations cruciales sur le mécanisme de transfert direct d'électrons dans un supercomplexe respiratoire. Les dimensions du supercomplexe étaient de l'ordre de 200 x 70 x 120 , dans une architecture linéaire symétrisée complètement différente des supercomplexes respiratoires précédemment rapportés. Par composition, le dimère linéaire CIV
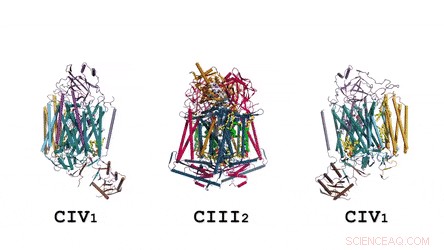
La composition et la structure du dimère CIII. La ménaquinone/ménaquinol se présente sous forme de sphères solides vert vif et les phospholipides sont des bâtonnets jaunes. Crédit: Science , doi:10.1126/science.aat8923
Au cours d'expériences de culture de cellules bactériennes, les auteurs ont utilisé une souche mutante de M. smegmatis résistante au peroxyde d'hydrogène de type M. tuberculosis. Les cellules ont été cultivées et la membrane isolée comme décrit précédemment. Après culture cellulaire, récolte et lyse cellulaire, des pastilles de membrane cellulaire ont été récoltées pour extraire les supercomplexes respiratoires. Les supercomplexes ont été caractérisés par spectroscopie optique, spectroscopie de masse et 3, Coloration à la 3'-diaminobenzidine (DAB). Pour identifier les groupes hémiques, les fractions sélectionnées ont été analysées en enregistrant les spectres avant et après réduction avec du dithionate comme décrit précédemment. Les échantillons purifiés ont été analysés à l'aide de la spectroscopie de masse native pour étudier l'architecture et les composants structurels individuels ont été analysés à l'aide de protocoles préalablement établis.
Pendant l'analyse cryo-EM, les chercheurs ont utilisé de l'acétate d'uranyle (1 % p/v) pour la coloration négative, en utilisant 5 µl de l'échantillon supercomplexe à une concentration de 0,05 mg/ml, les images ont été prises sur un microscope FEI Tecnai Spirit fonctionnant à 120 kV pour la construction initiale du modèle. Les images acquises ont été traitées à l'aide d'une reconstruction à basse résolution du supercomplexe à partir de 53 micrographies de l'échantillon coloré en négatif. Pour une reconstruction complète du supercomplexe, les auteurs ont sélectionné manuellement 7, 600 micrographies de 8, 200 micrographies originales lors du traitement d'images cryo-EM. Toutes les figures de l'étude ont été créées à l'aide d'une chimère PyMOL ou UCSF.

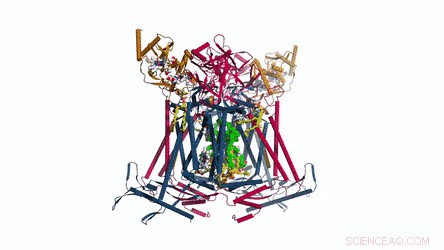
La composition et la structure du CIV. Représentation caricaturale du complexe IV. Les phospholipides sont représentés par des bâtonnets jaunes. Crédit: Science , doi:10.1126/science.aat8923
Les auteurs ont révélé la structure cryo-EM d'un supercomplexe respiratoire CIII-CIV de la bactérie M. smegmatis. La voie de transfert d'électrons intra-complexe allait de l'oxydation du quinol dans le CIII à la réduction de l'oxygène dans le CIV. Les résultats ont montré un nouveau mécanisme de bifurcation du transfert d'électrons pour assurer l'achèvement du cycle Q (le mouvement net des protons à travers une bicouche lipidique) pour la transduction d'énergie. L'association d'une superoxyde dismutase dans l'architecture du système peut protéger contre les dommages oxydatifs par les espèces réactives de l'oxygène (ROS). L'architecture des sites de liaison de la quinone a également fourni un cadre pour de futures études sur la découverte de médicaments antimicrobiens basés sur la structure.
© 2018 Réseau Science X