Lors de l'électrolyse de l'eau, l'électricité passe à travers l'eau pour la diviser en d'autres substances. Dans la réaction souhaitée, l'eau liquide (H2O) se divise en oxygène gazeux (O2) et en hydrogène gazeux (H2). Dans l'eau salée, le chlorure de sodium (NaCl) est présent sous forme d'ions sodium et chlore dissous (Na
+
et Cl
-
). Dans ce cas, une seconde réaction peut également se produire lors de l'électrolyse, dans lequel les ions chlore sont convertis en chlore gazeux (Cl
Le groupe de recherche dirigé par le chimiste de Leyde Marc Koper a découvert un catalyseur qui minimise la production de chlore gazeux lors de l'électrolyse de l'eau salée. L'invention peut permettre la production directe d'hydrogène à partir d'eau de mer. L'article a été publié dans le Journal de l'American Chemical Society .
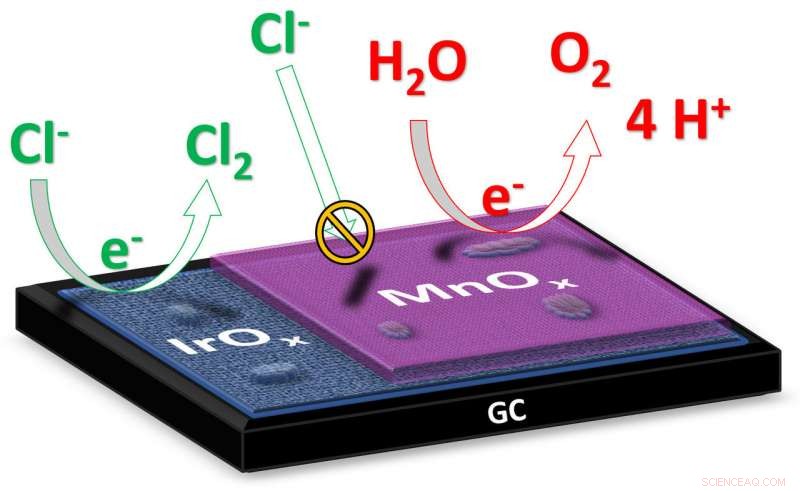
"Dans l'électrolyse de l'eau salée, comme l'eau de mer, le but ultime est de produire de l'hydrogène à la cathode, " explique Jan Vos, doctorant de l'Institut de chimie de Leiden. " Le produit formé à l'anode est idéalement de l'oxygène, car c'est sans danger pour l'environnement. pendant l'électrolyse de l'eau salée, du chlore gazeux toxique peut également se former à l'anode. Les chercheurs ont maintenant produit un catalyseur qui minimise la formation de chlore gazeux en faveur de la formation d'oxygène. Vos explique :« Le catalyseur est constitué de deux oxydes métalliques :l'oxyde d'iridium avec une couche d'oxyde de manganèse d'une douzaine de nanomètres d'épaisseur seulement. L'iridium est un matériau qui présente une activité catalytique élevée pour la formation à la fois d'oxygène gazeux et de chlore gazeux; l'oxyde de manganèse agit comme une sorte de membrane qui empêche l'apport d'ions chlorure et supprime la formation de chlore gazeux."
L'électrolyse de l'eau est une étape importante pour la production et l'utilisation de l'hydrogène comme vecteur énergétique alternatif. Une anode qui s'oppose à la formation de chlore gazeux permet l'électrolyse de l'eau où il n'est pas nécessaire de débarrasser d'abord l'eau du sel dissous, dont le processus coûte encore des quantités importantes d'énergie et de capital. Il permettrait la production directe d'hydrogène à partir d'eau de mer, soulageant ainsi les rares réserves d'eau douce sur terre.
Selon Vos, un effet secondaire utile de l'électrolyse de l'eau salée est la production d'eau douce très pure. « Si l'hydrogène gazeux extrait est finalement utilisé comme carburant, par exemple dans une pile à combustible d'une voiture, l'hydrogène réagit en eau avec l'oxygène gazeux de l'atmosphère. De cette façon, l'application à grande échelle de l'électrolyse de l'eau et de l'hydrogène dans les piles à combustible conduira à de grandes quantités de ce « déchet » :l'eau pure. Dans un avenir où les pénuries d'eau deviennent un problème de plus en plus aigu, ce ne serait certainement pas indésirable."
La recherche jette un nouvel éclairage sur une question en chimie qui dure depuis des décennies. « À l'origine, nous n'avions aucune idée de la raison pour laquelle les matériaux à base d'oxyde de manganèse avaient une sélectivité aussi élevée vis-à-vis de l'oxygène. Nous avons supposé qu'il s'agissait d'une propriété purement catalytique du matériau, mais effets possibles des barrières de diffusion :le blocage sélectif du transport des ions chlorure... Cela ne m'est même pas venu à l'esprit ! En réalité, c'est très basique, solution efficace à un problème très complexe. Cela a radicalement changé notre orientation de recherche. »
La découverte a des implications pour la sélectivité en électrolyse. La sélectivité est un critère important pour le bon fonctionnement d'un convertisseur catalytique. Dans de nombreux processus (électro-)chimiques, il est possible de former différents produits au cours d'une réaction, mais on espère que seul le produit requis est formé. Le moyen d'influencer la sélectivité est généralement de sélectionner le catalyseur très précisément et de l'affiner, mais cela prend beaucoup de temps et d'argent. De plus, il n'est pas toujours possible de combiner une sélectivité élevée avec une activité élevée, une autre caractéristique importante.
Selon Vos, la recherche s'intègre bien dans un domaine émergent, tendance alternative en électrocatalyse :l'utilisation de certains revêtements pour améliorer un catalyseur. "Une telle couche empêche les réactifs indésirables d'atteindre le catalyseur. Cela permet à un matériau catalytique actif mais non sélectif d'être rendu sélectif d'une manière alternative."