Les bibliothèques combinatoires sont un élément clé de la boîte à outils du chimiste pour le criblage de ligands. Les bibliothèques combinatoires dynamiques ajoutent une nouvelle dimension en liant synthèse et criblage. Maintenant, Des scientifiques britanniques ont développé une bibliothèque combinatoire dynamique pour le criblage de structures de ligands supramoléculaires qui reconnaissent les surfaces des protéines et pourraient interférer avec l'interaction protéine-protéine. L'étude a été publiée dans le Journal européen de chimie organique .
La chimie combinatoire a été adoptée par l'industrie pharmaceutique car elle permet aux chimistes de créer de grandes quantités de molécules et de les tester pour les propriétés souhaitées, par exemple, affinités de liaison à une cible thérapeutiquement importante. La synthèse et le criblage sont liés dans la chimie combinatoire dynamique car les bibliothèques combinatoires dynamiques peuvent modifier la distribution de leurs produits en réponse à la liaison cible. Ce processus d'amplification de produit génère des structures supramoléculaires autrement difficiles d'accès et permet l'identification rapide d'architectures de liaison, par exemple, inhibiteurs se liant au site actif d'une enzyme.
Cependant, les surfaces des protéines sont de grandes structures tridimensionnelles avec des taches d'hydrophobie différente, acidité, et basicité, trouvés dans des positions disparates sur leur surface. Par conséquent, le criblage d'inhibiteurs d'interactions protéine-protéine doit impliquer des ligands plus complexes que ceux nécessaires à la reconnaissance de site actif "Nous avions besoin d'identifier une chimie réversible et une méthodologie analytique qui serait compatible avec l'idée de faire de la chimie combinatoire dynamique pour la reconnaissance de surface des protéines, " dit Andrew J. Wilson, l'auteur correspondant de l'étude qui a été menée à l'Université de Leeds.
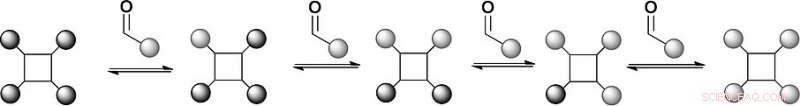
Les scientifiques ont choisi un échafaudage de tétraphénylporphyrine portant quatre hydrazides et des benzaldéhydes substitués comme bras de reconnaissance qui se lieraient de manière réversible aux hydrazides pour former des hydrazones. Les porphyrines sont des échafaudages établis pour la reconnaissance de la surface des protéines, mais la chimie de l'hydrazone est synthétiquement difficile. "Nous avons un échafaudage avec quatre hydrazones donc nous pouvons faire de la chimie d'échange sur quatre positions différentes, " dit Wilson. De plus, la chimie de formation d'hydrazone réversible a généralement lieu à un pH acide, mais les protéines préfèrent un pH neutre. Les scientifiques ont résolu ce problème en ajoutant un catalyseur à base d'aniline, qui a poussé la réaction d'échange d'hydrazone vers l'équilibre thermodynamique à un pH proche de la neutralité.
Dans la première configuration de cette bibliothèque de modèles, les chercheurs ont essayé deux ligands aldéhydes substitués, qui forme un équilibre avec l'hydrazone dérivée du benzaldéhyde. L'analyse par spectrométrie de masse a révélé que la distribution du produit était à l'équilibre thermodynamique, et les ligands en effet échangés par réaction réversible. Cela signifie que les conditions d'une bibliothèque combinatoire dynamique pour la reconnaissance de la surface des protéines ont été définies. Prochain, les scientifiques prévoient d'élaborer cette approche pour étudier la sélection dirigée par les protéines de mimétiques de surface de protéines.