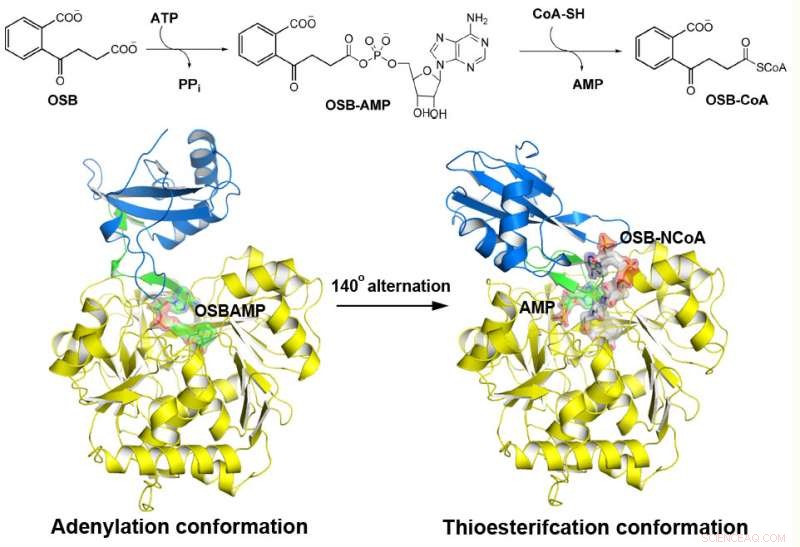
MenE catalyse une réaction en deux étapes dans deux structures différentes. Crédit :Département de chimie, HKUST
L'o-Succinylbenzoyl-CoA (OSB-CoA) synthétase (MenE) est une enzyme essentielle à la biosynthèse bactérienne de la vitamine K et une cible importante dans le développement de nouveaux antibiotiques. Il fait partie de la famille des enzymes adénylantes (ANL), qui reconfigurent leur site actif dans deux conformations actives différentes, l'un pour la demi-réaction d'adénylation et l'autre pour une demi-réaction de thioestérification, dans un mécanisme catalytique à alternance de domaine. Bien que plusieurs aspects du mécanisme d'adénylation dans MenE aient été récemment découverts, sa conformation de thioestérification reste insaisissable.
En utilisant une protéine mutante de Bacillus subtilis catalytiquement compétente complexée avec un analogue OSB-CoA, des chercheurs de l'Université des sciences et technologies de Hong Kong ont révélé un site actif de thioestérification spécifiquement conservé parmi les orthologues MenE et un mode de liaison au substrat distinct de ceux de nombreuses autres acyl/aryl-CoA synthétases. Plusieurs résidus qui contribuent spécifiquement à la demi-réaction de thioestérification sans affecter la demi-réaction d'adénylation ont été identifiés, et ils ont également observé un mouvement substantiel du groupe succinyle activé dans la demi-réaction de thioestérification.
Leurs conclusions ont été publiées dans le Journal de chimie biologique le 21 juillet, 2017.
"Nos résultats fournissent de nouvelles informations sur la catalyse par alternance de domaines d'une enzyme bactérienne essentielle à la biosynthèse de la vitamine K, et de ses homologues adénylants dans la famille des enzymes ANL, " a déclaré Zhihong Guo, professeur agrégé au Département de chimie de HKUST. "Notre travail a validé l'hypothèse selon laquelle un mode de liaison au substrat distinct est unique à cette enzyme."
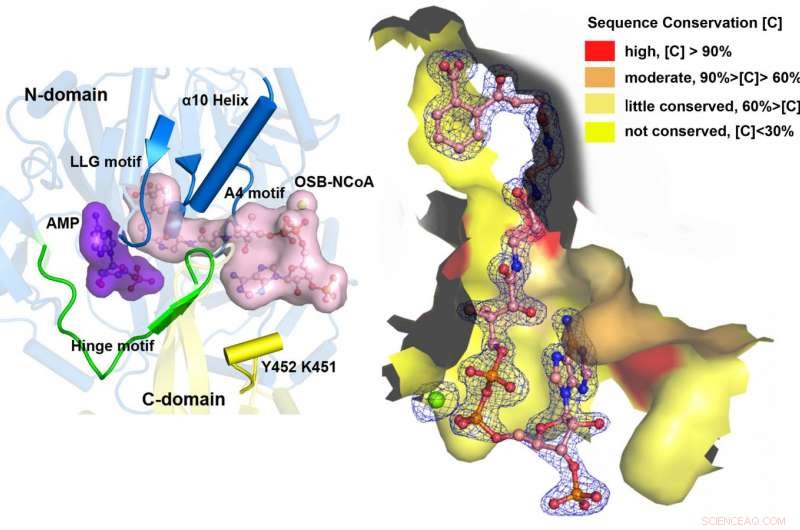
MenE catalyse une réaction en deux étapes dans deux structures différentes. Crédit :Département de chimie, HKUST
En tant que membre de la famille des enzymes ANL, L'OSB-CoA synthétase (MenE) est une cible médicamenteuse précieuse dans la voie de biosynthèse de la vitamine K, mais on sait encore peu de choses sur la structure de l'enzyme.
"Nous avons construit des structures cristallines à haute résolution d'un double mutant catalytiquement compétent (IRAK) de bsMenE en complexe avec un analogue de produit stable, OSB-NCoA, et une combinaison d'OSB-NCoA et d'AMP, " dit Guo. " De plus, ces structures cristallines ont révélé les résidus d'acides aminés contribuant à la reconnaissance et à la liaison des substrats et des produits dans la réaction de thioestérification. Ces résultats ont non seulement fourni un support sans ambiguïté pour le mécanisme catalytique d'alternance de domaine des enzymes ANL en général; ils ont également révélé le site actif de thioestérification unique des synthétases OSB-CoA et ont fourni la base structurelle de leur catalyse de la réaction de thioestérification pour faciliter leur utilité en tant que cible médicamenteuse. »
"Nos résultats fournissent de nouvelles informations sur le mécanisme d'alternance de domaine de l'enzyme biosynthétique essentielle de la vitamine K et de ses homologues dans la famille des enzymes ANL, et nous aidera à construire un cycle catalytique des protéines de manière continue, ce que personne n'a fait auparavant."