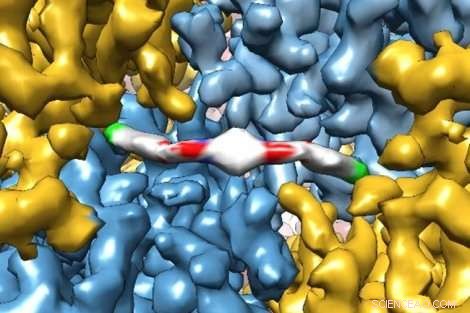
Une image révolutionnaire de cryo-microscopie électronique montre en détail comment une nouvelle molécule thérapeutique interagit avec une protéine, donner aux chercheurs un aperçu de son fonctionnement dans le corps humain. La molécule, ISRIB, a été montré dans une étude récente de Peter Walter de l'UCSF, Doctorat, et Susanna Rosi, Doctorat, pour restaurer les troubles de la mémoire chez les patients ayant subi un traumatisme crânien. Crédit :Adam Frost Lab
Des chercheurs de l'UC San Francisco ont récemment capturé des images exquises d'une protéine prise en train de se lier à un nouveau médicament thérapeutique avec une résolution suffisante pour modéliser la façon dont les atomes individuels de la protéine et du médicament s'alignent.
Jusque récemment, un tel exploit aurait été considéré comme impossible, mais au cours des cinq dernières années, de telles percées sont devenues presque monnaie courante ici, partie d'une révolution de résolution menée par des chercheurs de l'UCSF.
Grâce à leurs récents progrès en cryomicroscopie électronique (cryo-EM) - une technique dont les inventeurs ont été honorés par le prix Nobel de chimie 2017 - ces chercheurs ont permis des progrès rapides dans la recherche de thérapies plus précises et plus puissantes pour un large éventail de maladies humaines.
Les protéines sont de minuscules machines moléculaires qui alimentent tout ce que font nos cellules - et elles sont également les principales cibles des médicaments pharmaceutiques. Découvrir le fonctionnement de nouvelles protéines pourrait conduire à des thérapies salvatrices contre le cancer ou à de nouveaux analgésiques avec moins de risque de dépendance.
Mais pour vraiment comprendre comment fonctionnent les protéines, les chercheurs doivent pouvoir les visualiser à l'échelle atomique. Auparavant, cela nécessitait une croissance minutieuse des cristaux d'une protéine - un processus qui pouvait prendre des années à se mettre en place - puis des rayons X à travers les cristaux pour calculer la composition atomique de la protéine. Malheureusement, bon nombre des protéines et des complexes les plus intéressants ne peuvent pas être cristallisés.
Cryo-EM existe depuis les années 1970, mais depuis 2013 les avancées techniques initiées en partie par David Agard de l'UCSF, Doctorat, et Yifan Cheng, Doctorat, ont considérablement amélioré la capacité de cryo-EM à résoudre à la fois les protéines les plus petites et les plus complexes avec des détails époustouflants, transformer le microscope électronique d'une bête de somme à l'ancienne à l'arrière du laboratoire à la toute nouvelle superstar scientifique presque du jour au lendemain.
Cette renaissance cryo-EM a été stimulée par les efforts d'Agard et Cheng pour développer du matériel et des logiciels de caméra capables de détecter des électrons uniques - un objectif qui avait longtemps été considéré comme irréalisable par le domaine, mais que le duo a accompli en réunissant des scientifiques et des ingénieurs de l'UCSF, Laboratoire national Lawrence Berkeley, et Gatan, un Pleasanton, Californie, entreprise qui fabrique des caméras EM.
"Il n'y a pas si longtemps, tout le domaine pensait que le comptage d'électrons isolés ne fonctionnerait jamais, " se souvient Cheng. " Mais à l'UCSF, la culture nous encourage à faire des choses que tout le monde pense être impossibles."
Malgré le scepticisme de nombre de leurs pairs, Agard et Cheng – tous deux professeurs de biochimie et de biophysique à l'UCSF et chercheurs du Howard Hughes Medical Institute – ont reconnu que la capture d'électrons uniques était essentielle à la capacité des microscopes électroniques à résoudre les protéines biologiques clés avec suffisamment de détails pour permettre aux scientifiques de comprendre leur fonction.
Une illustration montre les images cryo-EM possibles avant 2013 à l'extrême gauche et les images cryo-EM à résolution beaucoup plus élevée disponibles aujourd'hui sur la droite. Ces images à haute résolution permettent aux chercheurs de construire des modèles moléculaires de protéines difficiles à étudier (à l'extrême droite). Crédit :Martin Högbom/Académie royale des sciences de Suède
"Il ne s'agit pas seulement d'y voir un peu plus clair les protéines, " expliqua Agard. " Il y a un point précis où l'on passe de voir des taches plutôt inutiles à être capable d'interpréter directement la structure d'une molécule. Les caméras à comptage d'électrons ont vraiment fourni un bond en avant dans notre capacité à comprendre la chimie sous-jacente d'une protéine - à la fois comment elle fonctionne et comment vous pouvez concevoir des médicaments qui s'y lient."
Depuis leur premier article à succès en 2013 démontrant que les nouvelles caméras et logiciels pouvaient résoudre les protéines dans une résolution proche de l'atome, la technologie a été largement adoptée par le domaine. Il a également permis de grandes avancées dans les propres recherches de Cheng et Agard, de la compréhension des protéines clés de la sensation de douleur, qui pourrait être la cible d'une nouvelle génération de produits pharmaceutiques, aux découvertes sur la façon dont les protéines conservent leur forme appropriée, qui a des implications majeures pour le cancer et des maladies telles que la maladie d'Alzheimer qui sont caractérisées par des protéines difformes.
Un autre chercheur de premier plan en cryo-EM à l'UCSF, Adam Frost, MARYLAND, Doctorat, qui a rejoint l'université en tant que professeur assistant en 2014 pour profiter de la puissance de cette nouvelle technologie, a mené des efforts pour utiliser cryo-EM pour déterminer comment de nouvelles classes de médicaments se lient à leurs protéines cibles au niveau atomique.
"Cryo-EM is now allowing us to study proteins at a level of detail that would never have been possible just a few years ago, " Frost said.
Frost and Cheng have also been using cryo-EM to understand how signaling proteins on the surfaces of cells – key targets for pharmaceuticals from pain killers to cancer therapies – are influenced by the cell membranes in which they float and how proteins can bend and shape the membranes. Notamment, the ability to examine the structure of proteins in their native membranes – which had also been considered impossible by the field – was achieved for the first time in 2016 by Cheng.
The recent work with cryo-EM has been so successful that many researchers at UCSF have begun clamoring for a share of the limited microscopy time available on shared scopes. Heureusement, with the acquisition earlier this year of new fully automated cryo-electron microscopes, including a $5 million state-of-the-art Titan Krios system funded by the Howard Hughes Medical Institute, a $6 million Titan Krios funded by an anonymous donor for the UCSF Institute of Neurodegenerative Disease – part of the UCSF Weill Institute for Neurosciences – and a $3 million Arctica system funded by the National Institutes of Health and UCSF, more and more researchers across the University and the Bay Area will be able to take their research to the next level.
Agard sees the cryo-EM revolution as closely synergistic to other burgeoning efforts on campus to completely map out the biology of disease, such as the work of Nevan Krogan, Doctorat, the director of UCSF's Quantitative Biosciences Institute, who is mapping the common networks of genes and proteins that drive diseases ranging from cancer to HIV to schizophrenia; and the work of Brian Shoichet, Doctorat, whose lab in UCSF's School of Pharmacy uses protein structures to computationally design custom drugs that fit like lock and key into target proteins.
"There is a remarkably integrated pipeline being developed at UCSF, with new technologies and approaches feeding off one another to advance our knowledge of the biology of disease at every level, " Agard said. "This is beginning to have a huge impact all around campus, but now we need to scale it up to lower barriers and speed the transition from images to therapies."