Une nouvelle façon de voir des détails inférieurs à la moitié de la longueur d’onde de la lumière a révélé comment l’échafaudage à l’échelle nanométrique à l’intérieur des cellules se connecte à l’échelle macro pendant la division cellulaire. Contrairement aux techniques de superrésolution antérieures, celle développée et testée à l'Université du Michigan ne repose pas sur des molécules qui s'usent avec une utilisation prolongée.
La superrésolution peut révéler des structures allant jusqu’à 10 nanomètres, soit à peu près la même largeur que 100 atomes. Il a ouvert un tout nouveau monde en biologie et les techniques qui ont rendu cela possible ont reçu un prix Nobel en 2014. Cependant, sa faiblesse est qu'il ne peut prendre des instantanés que sur des dizaines de secondes. Cela rend impossible l'observation de l'évolution de la machinerie d'une cellule sur de longues périodes de temps.
"Nous nous demandions :lorsque le système dans son ensemble se divise, comment les structures à l'échelle nanométrique interagissent-elles avec leurs voisines à l'échelle nanométrique, et comment cette interaction s'étend-elle à la cellule entière ?" » a demandé Somin Lee, professeur adjoint de génie électrique et informatique à l'UM, qui a dirigé l'étude publiée dans Nature Communications. .
Pour répondre à cette question, Lee et ses collègues avaient besoin d’un nouveau type de superrésolution. Grâce à leur nouvelle méthode, ils ont pu surveiller une cellule en continu pendant 250 heures.
"La cellule vivante est un endroit très fréquenté avec des protéines qui s'activent ici et là. Notre superrésolution est très intéressante pour visualiser ces activités dynamiques", a déclaré Guangjie Cui, titulaire d'un doctorat. étudiant en génie électrique et informatique et co-premier auteur de l'étude avec Yunbo Liu, titulaire d'un doctorat. diplômé en génie électrique et informatique.
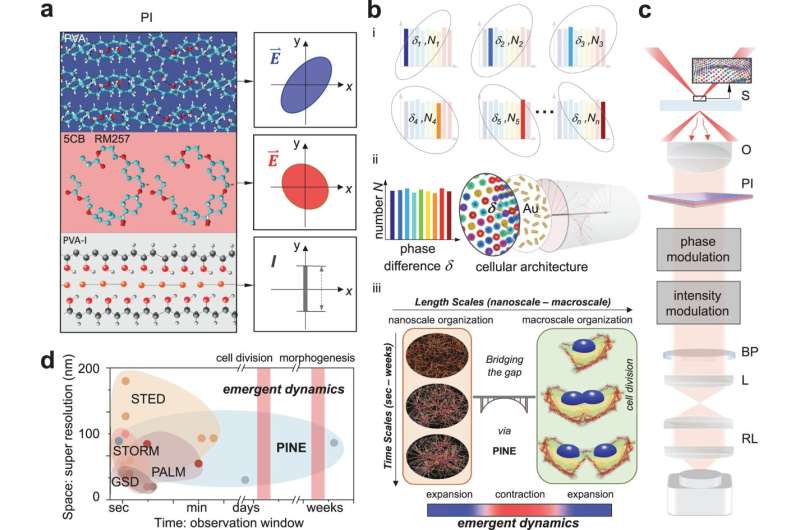
Comme la méthode originale, la nouvelle technique utilise des sondes à proximité des objets d’intérêt à l’échelle nanométrique pour les éclairer. La superrésolution 1.0 utilisait pour cela des fluorophores, des molécules fluorescentes qui enverraient une lumière de réponse après avoir été éclairées. Si les fluorophores étaient plus rapprochés que la taille de ce qui était imagé, l'image pourrait être reconstruite à partir des éclats de lumière produits par les fluorophores.
La nouvelle technique utilise des nanotiges d'or, qui ne se décomposent pas sous l'effet d'une exposition répétée à la lumière, mais il est plus difficile d'utiliser la lumière qui interagit avec elles. Les nanorodes réagissent à la phase de la lumière, ou à l'endroit où elle se trouve dans l'oscillation de haut en bas des champs électriques et magnétiques qui la composent. Cette interaction dépend de l'angle du nanorod par rapport à la lumière entrante.
Comme les fluorophores, les nanotiges peuvent se fixer à des structures cellulaires particulières en ciblant des molécules à leur surface. Dans ce cas, les nanorodes recherchaient l’actine, une protéine qui ajoute de la structure aux cellules molles. L'actine a la forme de filaments ramifiés, chacun mesurant environ 7 nanomètres (millionièmes de millimètre) de diamètre, bien qu'ils soient reliés entre eux pour s'étendre sur des milliers de nanomètres. Même si les nanobâtonnets font souvent plus de deux fois le diamètre de l'actine, les données qu'ils fournissent en groupe peuvent éclairer ses minuscules détails.
Pour localiser les nanotiges, l’équipe a construit des filtres constitués de fines couches de polymères et de cristaux liquides. Ces filtres ont permis la détection de la lumière avec une phase particulière, permettant à l'équipe de sélectionner des nanorods présentant des angles particuliers par rapport à la lumière entrante. En prenant 10 à 30 images, chacune examinant un sous-ensemble différent de nanorods, et en les fusionnant en une seule image, l'équipe a pu déduire les détails à l'échelle nanométrique des filaments à l'intérieur des cellules. Ces détails seraient flous dans les microscopes conventionnels.
Grâce à cette technique, l'équipe a découvert trois règles régissant la manière dont l'actine s'auto-organise pendant la division cellulaire :
Le comportement de l'actine est lié au comportement de la cellule, mais la cellule se contracte lorsque l'actine se dilate, et elle se dilate lorsque l'actine se contracte. L’équipe souhaite approfondir cette question et découvrir pourquoi les mouvements sont opposés à différentes échelles. Ils souhaitent également étudier les conséquences d'une dérégulation de ce processus moléculaire :est-ce à l'origine de certaines maladies ?
Plus largement, ils espèrent utiliser la superrésolution pour comprendre comment l'auto-organisation est intégrée aux structures biologiques, sans avoir besoin d'un contrôle central.
"Notre code génétique n'inclut pas suffisamment d'informations pour coder chaque détail du processus organisationnel", a déclaré Lee. "Nous voulons explorer les mécanismes des comportements collectifs sans coordination centrale qui ressemblent à des oiseaux volant en formation, dans lesquels le système est piloté par les interactions entre les parties individuelles."
Plus d'informations : Guangjie Cui et al, Le nanoscope à intensité de phase (PINE) ouvre des fenêtres d'investigation à long terme sur la matière vivante, Nature Communications (2023). DOI :10.1038/s41467-023-39624-w
Informations sur le journal : Communications naturelles
Fourni par l'Université du Michigan