Des chercheurs de l'Université Yale, à New Haven, ont optimisé un véhicule d'ARNm à base de polymère pour une administration ciblée dans les poumons et ont démontré le potentiel de la plateforme pour la vaccination des muqueuses contre les agents pathogènes respiratoires.
Dans un article intitulé "Les nanoparticules polymères délivrent de l'ARNm aux poumons pour la vaccination des muqueuses", publié dans Science Translational Medicine , l'équipe présente sa création d'ARN messager (ARNm) inhalable à usage thérapeutique.
La recherche clinique a cherché un moyen efficace et ciblé d’administrer l’ARNm aux poumons pour diverses applications thérapeutiques, notamment les thérapies de remplacement des protéines, l’édition génétique et la vaccination. Les principaux défis ont été de maintenir la stabilité de l'ARNm et d'éviter les interférences immunitaires.
L’équipe de Yale a créé des formulations de polymères PACE (Polymerized Albumin Conjugates for mRNA Encapsulation) pour délivrer l’ARNm local aux poumons. Les chercheurs ont optimisé les polyplexes PACE pour améliorer la protection de l'ARNm, l'efficacité de la transfection et la présentation des antigènes pour des stratégies thérapeutiques et de vaccination efficaces spécifiques aux poumons.
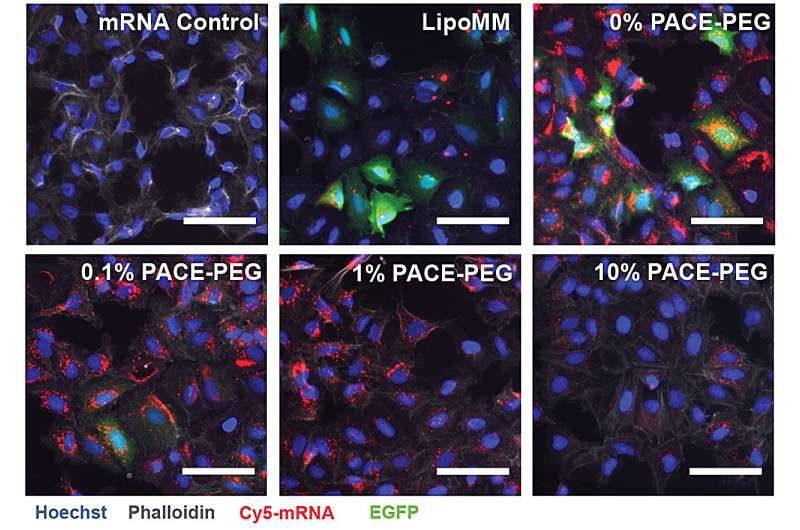
Pour stabiliser le PACE, un rapport optimisé de molécules de polyéthylène glycol (PEG) a été intégré dans la structure du polymère au cours du processus de copolymérisation enzymatique, ce qui a stabilisé les polyplexes et modifié les caractéristiques clés. Le PEG a pu affecter la taille, la charge de surface et d'autres propriétés des polyplexes, les rendant plus adaptés au chargement et plus efficaces pour la délivrance d'ARNm aux cellules pulmonaires.
La formulation stabilisée a donné de mauvais résultats dans une expérience de culture cellulaire in vitro. Les chercheurs notent que les méthodes traditionnelles de culture cellulaire ne sont pas de bons prédicteurs des systèmes de délivrance, que ce soit de manière positive ou négative. L’environnement du corps, en particulier les poumons, interagit très différemment d’un ensemble de cellules. Par exemple, les surfaces muqueuses sont manquantes, et ces surfaces sont exactement ce dont le système PACE-PEG est conçu pour tirer parti. Le véritable test viendrait in vivo avec un modèle de souris.
Les chercheurs ont encapsulé l’ARNm codant pour la protéine de pointe du SRAS-CoV-2 dans PACE et inoculé des souris sensibles à l’infection par le SRAS-CoV-2. Les souris ont reçu une dose de 10 μg d'ARNm PACE administrée par voie intranasale aux jours 0 et 28. Le développement de l'immunité adaptative dans les ganglions lymphatiques médiastinaux a été testé et confirmé 14 jours après le rappel.
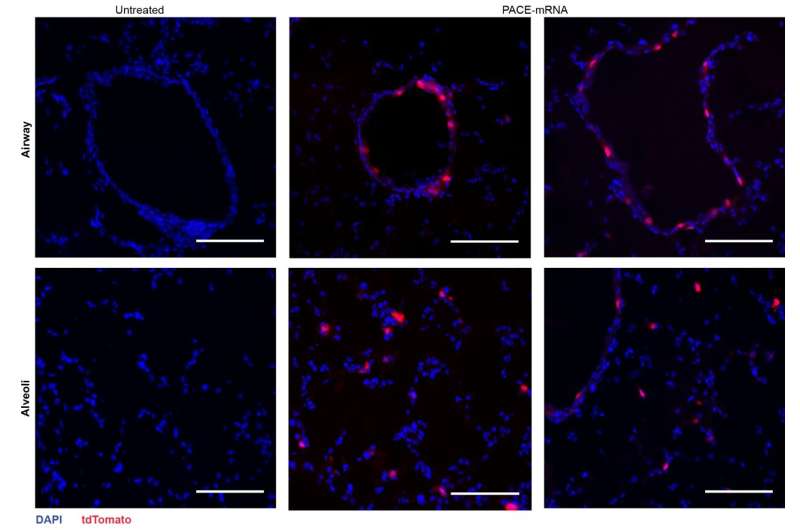
Après avoir évalué la réponse immunitaire locale, les chercheurs ont examiné les tissus pulmonaires, le sérum sanguin et le liquide de lavage broncho-alvéolaire pour détecter les réponses locales et systémiques des lymphocytes T et des anticorps spécifiques à l'antigène. La transfection s'est produite principalement dans les cellules épithéliales pulmonaires et les cellules présentatrices d'antigène, deux types de cellules qui sont des cibles pertinentes pour les maladies pulmonaires.
La vaccination a réussi à augmenter les CD8 + spécifiques à la protéine Spike. Cellules T dans le tissu pulmonaire et CD8 circulants + Cellules T dans la circulation sanguine. CD8 + Les lymphocytes T exprimaient des marqueurs indiquant la mémoire résidant dans les tissus. Les anticorps IgG circulants et muqueux ont été trouvés à des concentrations significativement plus élevées chez les souris vaccinées.
Les souris ont ensuite été exposées à une dose mortelle de SARS-CoV-2. La vaccination PACE-ARNm a réduit de manière significative la charge virale dans les poumons et amélioré le poids et la survie des souris vaccinées. Cette protection a été attribuée à la réponse immunitaire spécifique à la protéine Spike induite par la vaccination.
Le groupe témoin n'a montré aucun signe de réponse immunitaire spécifique à la protéine Spike et n'a pas présenté de charge virale réduite ni d'amélioration de la survie après la provocation virale.
L'étude présente les polyplexes PACE-ARNm comme une méthode prometteuse pour l'administration efficace et ciblée d'ARNm aux poumons avec des avantages potentiels à la fois pour l'expression thérapeutique des protéines et la vaccination des muqueuses contre les agents pathogènes respiratoires.
L'étude illustre également l'importance des modèles animaux, par opposition à la culture cellulaire seule, pour déterminer les effets réels. Les résultats positifs indiquent que des recherches supplémentaires sont justifiées, avec des tests supplémentaires prévus sur des modèles animaux plus grands.
Plus d'informations : Alexandra Suberi et al, Les nanoparticules polymères délivrent de l'ARNm aux poumons pour la vaccination des muqueuses, Science Translational Medicine (2023). DOI :10.1126/scitranslmed.abq0603
Informations sur le journal : Science Médecine translationnelle
© 2023 Réseau Science X