Une nouvelle étude met en évidence le potentiel des structures d'ADN artificielles qui, lorsqu'elles sont équipées d'anticorps, demandent au système immunitaire de cibler spécifiquement les cellules cancéreuses.
L’immunothérapie est considérée comme une arme exceptionnellement prometteuse dans la lutte contre le cancer. L'objectif est essentiellement d'activer le système immunitaire de l'organisme de manière à ce qu'il identifie et détruise les cellules malignes. Cependant, la destruction doit être la plus efficace et spécifique possible, pour éviter d'endommager les cellules saines.
Une équipe de chercheurs du LMU, de l'Université technique de Munich (TUM) et de Helmholtz Munich ont publié une nouvelle étude dans Nature Nanotechnology dans lequel ils présentent une méthode prometteuse pour développer des agents définis par l'utilisateur qui peuvent précisément faire cela.
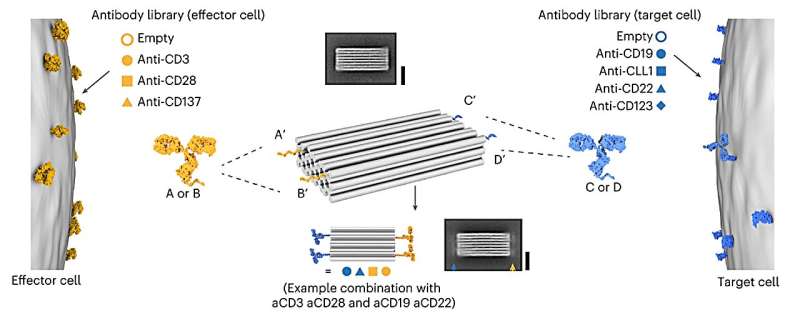
"La pièce maîtresse est un minuscule châssis de brins d'ADN repliés qui peuvent être spécifiquement équipés de n'importe quel anticorps", explique le professeur Sebastian Kobold, l'un des principaux auteurs. À l'hôpital universitaire de Munich, son équipe a étudié l'impact des nouveaux substrats in vitro et in vivo.
Cette nouvelle classe d'agents, appelés « engageurs de cellules T programmables » (PTE), est créée avec l'origami d'ADN, une nanotechnologie dans laquelle des brins d'ADN auto-repliés s'assemblent en une structure simulée à l'avance sur un ordinateur. Leur conception permet de fixer différents anticorps dans quatre positions.
Les anticorps qui se lient spécifiquement à certaines cellules tumorales sont ajoutés d'un côté, tandis que les anticorps reconnus par les cellules T du système immunitaire sont montés de l'autre. Les lymphocytes T détruisent alors les cellules marquées. "Cette approche nous permet de produire toutes sortes de PTE différents et de les adapter pour obtenir des effets optimisés", explique le Dr Adrian Gottschlich, l'un des principaux auteurs de l'étude.
"Des combinaisons infinies sont en théorie possibles, faisant du PTE une plateforme très prometteuse pour traiter le cancer." Les scientifiques ont produit 105 combinaisons différentes d'anticorps pour l'étude, les testant in vitro pour voir dans quelle mesure ils se sont spécifiquement attachés aux cellules cibles et dans quelle mesure ils ont réussi à recruter des lymphocytes T. Les combinaisons ont pu être générées de manière modulaire et sans l'optimisation préalable et très fastidieuse des anticorps.
L’équipe a pu prouver que plus de 90 % des cellules cancéreuses avaient été détruites après 24 heures. Pour savoir si cela fonctionnait également dans les organismes vivants, le professeur Kobold et ses collègues ont examiné si les PTE reconnaissaient et induisaient également la destruction des cellules cancéreuses dans les organismes porteurs de tumeurs. "Nous avons pu prouver que nos PTE fabriqués à partir de structures d'ADN origami fonctionnent également in vivo", explique Gottschlich.
Gottschlich explique que grâce à la possibilité de monter différents anticorps en même temps, les cellules tumorales peuvent être ciblées de manière beaucoup plus précise. Il est également plus facile de contrôler l’activation du système immunitaire. Cela augmente les chances de traiter avec succès le cancer en distinguant plus précisément les cellules malades et saines et en minimisant ainsi les effets secondaires. À la lumière de la nature modulaire, de l'adaptabilité et du degré élevé d'adressabilité des technologies d'origami ADN, les chercheurs s'attendent à ce qu'un large spectre de plates-formes d'immunothérapie complexes et même contrôlées par la logique puissent être développées.
Les scientifiques de TUM, le Dr Klaus Wagenbauer, le Dr Benjamin Kick, le Dr Jonas Funke et le professeur Hendrik Dietz, comptent tous parmi les fondateurs de Plectonic Biotech GmbH qui souhaite développer et commercialiser davantage la technologie sur laquelle reposent les PTE. Sebastian Kobold déclare :"Nous pensons que nos résultats permettront de tester cliniquement les nanotechnologies de l'ADN et de démontrer le potentiel des stratégies d'ingénierie biomoléculaires basées sur l'origami de l'ADN pour les applications médicales."
Plus d'informations : Klaus F. Wagenbauer et al, Enclencheurs de cellules T multispécifiques programmables à base d'ADN-origami, Nature Nanotechnology (2023). DOI :10.1038/s41565-023-01471-7
Informations sur le journal : Nanotechnologie naturelle
Fourni par l'Université Ludwig Maximilian de Munich