Cibler les tumeurs malignes avec une grande précision constitue un défi pour les chercheurs biomédicaux. Cependant, ce scénario est susceptible d'assister à un changement de paradigme dans un avenir proche grâce à l'utilisation de bactéries spécialement conçues pour éliminer efficacement les cellules malignes.
L’utilisation de bactéries pour cibler les cellules cancéreuses, ou thérapie bactérienne, peut être encore améliorée grâce au génie génétique et à la nanotechnologie. Cependant, son efficacité pourrait être freinée en raison de contraintes techniques et du développement potentiel d’une résistance aux antibiotiques. Par conséquent, il est crucial de parvenir à une modification chimique modérée mais efficace des bactéries pour améliorer leur biocompatibilité et leur fonctionnalité, de manière à ce que leurs capacités médicales ne soient pas compromises.
Récemment, certains types de bactéries photosynthétiques violettes (PPSB) ont été mis en lumière pour leur potentiel à relever les défis de la thérapie bactérienne. Pour approfondir cette question, les chercheurs ont publié une étude dans Nano Today. qui rapporte l'utilisation de PPSB chimiquement modifié pour détecter et éliminer les cellules cancéreuses difficiles à éradiquer dans un modèle murin.
L'étude, dirigée par le professeur agrégé Eijiro Miyako de l'Institut avancé des sciences et technologies du Japon (JAIST), a sélectionné Rhodopseudomonas palustris (RP) comme bactérie optimale pour mener les études. "Le RP a démontré d'excellentes propriétés, telles que la fluorescence dans le proche infrarouge (NIR), la conversion photothermique et une faible cytotoxicité. Il absorbe la lumière NIR et produit des radicaux libres, une propriété qui peut être utilisée pour tuer les cellules cancéreuses", explique le professeur Miyako.
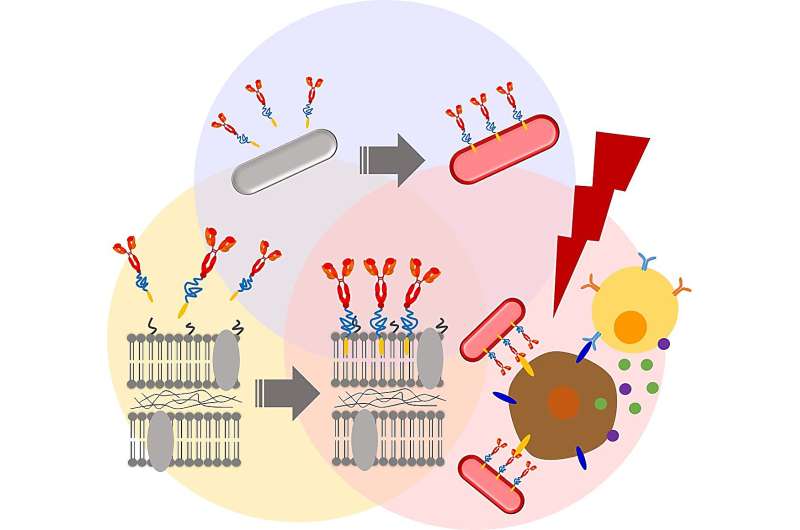
Pour tenter d'améliorer l'efficacité thérapeutique de la souche isolée, l'équipe a recherché des modifications chimiques pour modifier les membranes bactériennes. Tout d’abord, ils ont effectué une PEGylation membranaire, ou la fixation de dérivés de polyéthylène glycol aux parois cellulaires bactériennes. Des recherches antérieures indiquent que la PEGylation bactérienne aide à échapper à la réponse immunitaire de l'hôte et convertit l'énergie lumineuse en chaleur, qui peut ensuite être utilisée pour éliminer sélectivement les cellules cancéreuses.
Les premiers résultats étaient encourageants. Par exemple, le revêtement de la surface de la membrane RP avec une ancre biocompatible pour membrane (BAM) n’a pas affecté négativement la viabilité des cellules RP pendant au moins une semaine. De plus, les RP fonctionnalisés par BAM n'ont pas été éliminés par phagocytose par les macrophages, des cellules qui jouent un rôle clé dans les actions défensives du système immunitaire contre les invasions bactériennes.
Ensuite, les chercheurs ont attaché un conjugué fluorescent Alexa488-BSA aux RP fonctionnalisés par BAM, créant ainsi un complexe bactérien avec un marqueur fluorescent traçable. Ce conjugué a ensuite été remplacé par un anticorps PD-L1. Des études antérieures ont montré que les cellules cancéreuses expriment à leur surface une protéine appelée Programmed Cell Death Ligand 1 (PD-L1). PD-L1 peut désactiver en douceur le système de défense de l'hôte en se liant aux récepteurs PD-1. Cela permet aux cellules cancéreuses d’échapper à la détection et à l’élimination immunitaire. Les anticorps anti-PD-L1 bloquent cette interaction, empêchant ainsi les cellules cancéreuses de contourner la destruction médiée par le système immunitaire.
Comme prévu, les anti-PD-L1 – BAM – RP et RP ont inhibé la croissance tumorale dans un modèle murin de cancer du côlon. Cependant, les anti-PD-L1 – BAM – RP, BAM – RP et RP, lorsqu'ils sont excités par un laser, ont montré un effet anticancéreux particulièrement spectaculaire. En fait, les tumeurs solides ont complètement disparu après l’irradiation laser d’anti-PD-L1 – BAM – RP, BAM – RP ou RP injectés à des souris porteuses de tumeurs. De plus, lors de l'évaluation des propriétés de conversion photothermique, l'anti-PD-L1-BAM-RP et la RP naturelle ont présenté une forte conversion photothermique en raison de la présence de molécules de bactériochlorophylle (BChl) induites par la lumière.
Parmi les différents bioconjugués, l’anti-PD-L1 – BAM – RP a montré la plus grande efficacité au stade initial du traitement. De plus, il n’était pas toxique pour les cellules saines environnantes ni pour l’hôte murin. Des expériences ultérieures ont révélé le mécanisme sous-jacent à l'annihilation de la tumeur du côlon dans le modèle murin.
"Nos résultats ont révélé que les bactéries fonctionnelles actionnées par la lumière ont démontré des fonctions optiques et immunologiques efficaces dans le modèle murin du cancer du côlon. De plus, la fluorescence NIR des complexes bactériens modifiés a été utilisée pour localiser les tumeurs, ouvrant ainsi la voie à une future traduction clinique." dit le professeur Miyako.
Il ajoute en outre :"Nous pensons que cette technologie bactérienne pourrait être disponible pour des essais cliniques dans 10 ans et avoir des implications positives pour le diagnostic et le traitement du cancer."
Plus d'informations : Sheethal Reghu et al, Immunotheranostics du cancer utilisant des complexes bactériens photosynthétiques bioactifs nanoenrobés, Nano Today (2023). DOI :10.1016/j.nantod.2023.101966
Informations sur le journal : Nano aujourd'hui
Fourni par l'Institut avancé des sciences et technologies du Japon