La diminution des ressources énergétiques conventionnelles basées sur les combustibles fossiles et leurs conséquences environnementales associées ont attiré l'attention du monde entier vers le développement des ressources énergétiques renouvelables. Ces ressources énergétiques renouvelables pourraient ne pas répondre à la totalité de la demande énergétique de la population mondiale; cependant, ils limitent les effets des gaz à effet de serre ainsi que la pollution atmosphérique causée par la combustion des combustibles fossiles. Parmi les ressources alternatives, l'hydrogène est considéré comme le vecteur d'énergie le plus propre.
Cependant, l’hydrogène n’existe pas dans la nature à l’état pur, comme l’oxygène, et doit être produit à partir de ressources contenant de l’hydrogène telles que le gaz naturel (méthane), le charbon, la biomasse et l’eau, par reformage, décomposition thermique ou électrolyse. Mais la production d'hydrogène à partir de gaz naturel, de charbon et de biomasse entraîne l'émission de gaz à effet de serre, le dioxyde de carbone (CO2 ).
Nous savons que l'eau (H2 O) est constitué d’atomes d’hydrogène et d’oxygène ; l’eau de mer pourrait donc être une source illimitée d’hydrogène. L’hydrogène est donc envisagé comme un substitut possible aux combustibles fossiles. La production d'énergie à partir d'énergies renouvelables (en utilisant l'énergie éolienne, l'énergie solaire, l'hydroélectricité, l'énergie houlomotrice ou similaire) est appelée « hydrogène vert ». Dans ce scénario, la division de l'eau en hydrogène et oxygène à l'aide d'électricité renouvelable dans un électrolyseur à la surface d'un électrocatalyseur robuste est une technique proposée.
Malgré les progrès dans le domaine, le processus de projection d’eau pour produire de l’hydrogène vert à un prix abordable reste lent en raison des limitations liées aux électrocatalyseurs efficaces. En théorie, l'eau se divise à 1,23 V. Cependant, en pratique, cette valeur est supérieure à 1,5 V (ce qui signifie un gaspillage d'énergie supplémentaire). Cette énergie minimale est théoriquement nécessaire pour briser la molécule d'eau. Des électrocatalyseurs coûteux à base de métaux nobles et précieux, par exemple Pt, Pd, Au, Rh, Ir, etc., sont utilisés dans l'électrolyseur pour ce processus.
Les principaux problèmes auxquels sont confrontés l'industrie et les experts sont l'oxydation de l'eau pour produire de l'O2. et la stabilité du catalyseur dans des conditions alcalines industrielles difficiles. Dans le premier problème, la réaction demi-cellule est une réaction ascendante où quatre électrons sont impliqués et où l'essentiel de l'énergie est nécessaire en dehors de la perte d'énergie liée à la résistivité des différents composants (électrolyte, connexions, catalyseur, etc.) l'électrolyseur. Dans le deuxième problème, les catalyseurs coûteux perdent souvent leur activité en raison de la dégradation de la surface. Dans ces conditions, un électrocatalyseur bon marché et abordable, mais hautement actif et stable, est nécessaire pour une telle réaction de division de l'eau.
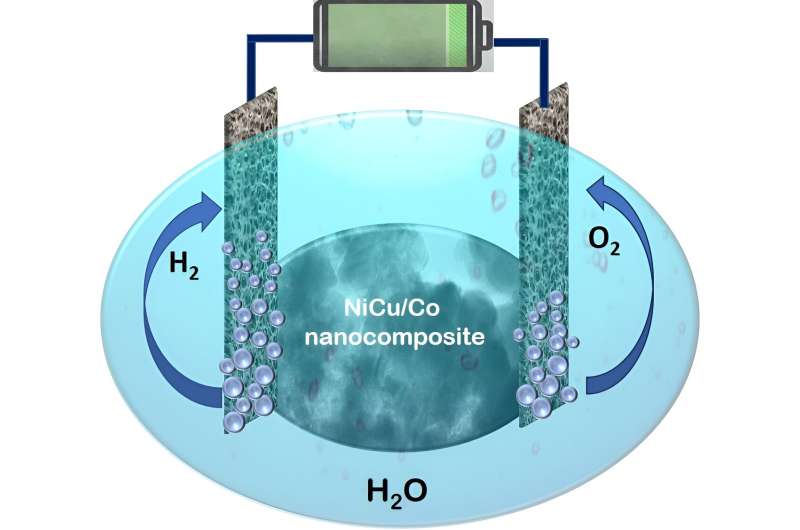
Dans une étude récente, notre équipe, dirigée par Sasanka Deka, a conçu et développé un nouvel électrocatalyseur à base de nanocomposites, très efficace, mais toujours rentable, pour la division globale de l'eau. Un nanocomposite est un mélange homogène de deux ou plusieurs matériaux présents dans la gamme nanométrique. Le présent nanocomposite est une nanoarchitecture basée sur des nanoparticules désalliées de NiCu sur des nanofeuillets hiérarchiques de Co. Nos résultats sont publiés dans la revue ACS Catalysis .
Les matériaux utilisés sont moins chers que les métaux précieux et la procédure de synthèse est très pratique. Ce nouveau catalyseur a été utilisé dans un électrolyseur à électrolyte d'hydroxyde de potassium (KOH) pour la séparation de l'eau. Il est intéressant de noter que le système montre la division de l’eau et la production d’hydrogène gazeux à l’aide de l’électrocatalyseur NiCu/Co à une tension de cellule de 1,46 V. Ainsi, l'électrocatalyseur est capable de diviser l'eau en utilisant uniquement une batterie domestique de 1,5 volts.
D'autres points clés concernant l'électrocatalyseur NiCu/Co sont que la production d'hydrogène vert s'effectue avec une densité de courant élevée d'importance industrielle, une stabilité élevée (6 000 cycles) et une durabilité (60 h) du catalyseur. Il fonctionne également avec un électrolyte industriel contenant 30 % en poids d'électrolyte KOH et la tension de cellule proposée est bien inférieure à celle d'un IrO2 commercial. ||Catalyseur Pt/C.
Des études expérimentales et informatiques détaillées ont été réalisées pour comprendre la raison de cette efficacité. Les résultats corroborés soutiennent notre hypothèse initiale de lixiviation sélective des matériaux pour créer une structure plus poreuse, et l'utilisation de différents centres métalliques et formes de matériaux pour le dégagement d'hydrogène et d'oxygène.
En résumé, nous avons développé une méthode simple mais avancée et rentable pour concevoir un électrocatalyseur bifonctionnel à base de nanocomposites composé de nanofeuilles de NiCu désallié sur Co, capable de diviser l'eau à 1,46 V avec une grande stabilité. Nous espérons que notre produit pourra être utile pour une synthèse à grande échelle et une utilisation commerciale dans les électrolyseurs pour la production d'hydrogène vert.
Cette histoire fait partie de Science X Dialog, où les chercheurs peuvent rapporter les résultats de leurs articles de recherche publiés. Visitez cette page pour plus d'informations sur ScienceX Dialog et comment participer.
Plus d'informations : Ankur Kumar et al, Conception de la nanoarchitecture de nanoparticules désalliées de NiCu sur des nanofeuilles hiérarchiques de Co pour la division globale de l'eau alcaline à basse tension de cellule, Catalyse ACS (2023). DOI :10.1021/acscatal.3c02096
Informations sur le journal : Catalyse ACS
Le Dr Sasanka Deka est professeur de chimie à l'Université de Delhi. Il a obtenu son doctorat. diplôme du Laboratoire national de chimie (NCL-Pune). Il a effectué ses recherches postdoctorales au Laboratoire national de nanotechnologie, CNR-INFM, Lecce, Italie et à l'Institut italien de technologie (IIT), Gênes, Italie. Il a reçu le SHRI RAM ARORA AWARD 2008 de la Fondation TMS, décerné par la Minerals, Metals &Materials Society (TMS), Warrendale, États-Unis ; Prix de recherche DAE-BRNS pour jeunes scientifiques 2011, meilleur exposé oral du RSC – 2015, Institut de physique (IOP), article le mieux cité du Royaume-Uni – Inde 2019 et article le mieux cité du RSC en 2020. Le Dr Deka a publié plus de 75 articles de recherche dans différents des revues internationales à fort impact, détient trois brevets et a également écrit deux livres et trois chapitres de livres publiés par un éditeur international. Il a géré avec succès plusieurs projets de recherche extra-muros nationaux et internationaux. Ses intérêts de recherche actuels portent sur la nanochimie synthétique et les nouveaux nanomatériaux pour la recherche énergétique.