Les cages protéiques trouvées dans les microbes aident leur contenu à résister aux conditions difficiles de l'environnement intracellulaire, une observation qui a de nombreuses applications en bio-ingénierie. Les chercheurs de Tokyo Tech ont récemment développé une approche innovante de bio-ingénierie qui utilise des bactéries génétiquement modifiées pour incorporer des cages protéiques autour des cristaux de protéines. Cette méthode de biosynthèse intracellulaire produit efficacement des complexes protéiques hautement personnalisés, qui pourraient trouver des applications en tant que catalyseurs solides avancés et nanomatériaux fonctionnalisés.
Dans la nature, les protéines peuvent s’assembler pour former des complexes organisés ayant une myriade de formes et de fonctions. Grâce aux progrès remarquables de la bio-ingénierie au cours des dernières décennies, les scientifiques peuvent désormais produire des assemblages de protéines personnalisés pour des applications spécialisées. Par exemple, les cages à protéines peuvent confiner des enzymes qui agissent comme catalyseurs d’une réaction chimique ciblée. De même, les cristaux de protéines (structures composées d'unités répétitives de protéines) peuvent servir d'échafaudages pour synthétiser des matériaux solides avec des terminaux fonctionnels exposés.
Cependant, incorporer (ou « encapsuler ») des protéines étrangères à la surface d’un cristal de protéine est un défi. Ainsi, la synthèse de cristaux de protéines encapsulant des assemblages de protéines étrangères s’est avérée difficile à réaliser. Jusqu’à présent, il n’existe aucune méthode efficace pour atteindre cet objectif et les types de cristaux de protéines produits sont limités. Mais et si la machinerie cellulaire bactérienne était la solution ?
Dans une étude récente, une équipe de recherche de l'Institut de technologie de Tokyo, dont fait partie le professeur Takafumi Ueno, a signalé une nouvelle méthode cellulaire permettant d'encapsuler des cages protéiques ayant diverses fonctions sur des cristaux de protéines. Leur article, publié dans Nano Letters , représente une avancée majeure dans l'ingénierie des cristaux de protéines.
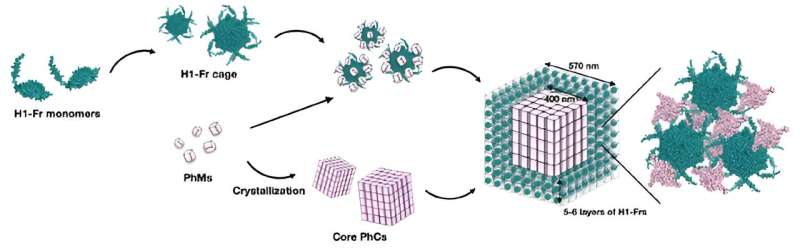
La stratégie de l'équipe consiste à modifier génétiquement la bactérie Escherichia coli pour produire deux éléments constitutifs principaux :le monomère de polyédrine (PhM) et la ferritine modifiée (Fr). D’une part, les PhM se combinent naturellement au sein des cellules pour former un cristal protéique bien étudié appelé cristal de polyèdres (PhC). D'un autre côté, on sait que les unités 24 Fr se combinent pour former une cage protéique stable.
"La ferritine a été largement utilisée comme modèle pour construire des bio-nano matériaux en modifiant ses surfaces internes et externes. Ainsi, si la formation d'une cage Fr et son immobilisation ultérieure sur PhC peuvent être réalisées simultanément dans une seule cellule, les applications de les cristaux de protéines dans les cellules en tant que matériaux bio-hybrides seront développés", explique le professeur Ueno.
Pour immobiliser les cages Fr dans PhC, les chercheurs ont modifié le gène codant pour Fr pour inclure une étiquette α-hélice (H1) de PhM, créant ainsi H1-Fr. Le raisonnement derrière cette approche est que les hélices H1 naturellement présentes dans les molécules PhM interagissent de manière significative avec les étiquettes de H1-Fr, agissant comme des « agents de recrutement » qui lient les protéines étrangères sur le cristal.
À l’aide de techniques avancées de microscopie, d’analyse et de chimie, l’équipe de recherche a vérifié la validité de l’approche proposée. Grâce à diverses expériences, ils ont découvert que les cristaux résultants avaient une structure noyau-coquille, à savoir un noyau cubique en PhC d'environ 400 nanomètres de large recouvert de cinq ou six couches de cages H1-Fr.
Cette stratégie de biosynthèse de cristaux de protéines fonctionnelles est très prometteuse pour des applications en médecine, en catalyse et en ingénierie des biomatériaux. "Les cages H1-Fr ont le potentiel d'immobiliser des molécules externes à l'intérieur pour une délivrance moléculaire", explique le professeur Ueno.
"Nos résultats indiquent que les structures noyau-coquille H1-Fr/PhC, affichant des cages H1-Fr sur la surface externe du noyau PhC, peuvent être contrôlées individuellement à l'échelle nanométrique. En accumulant différentes molécules fonctionnelles dans le noyau PhC et H1 -En cage, des cristaux hiérarchiques contrôlés à l'échelle nanométrique peuvent être construits pour des applications biotechnologiques avancées."
Les travaux futurs dans ce domaine nous aideront à réaliser le véritable potentiel des cristaux et des assemblages de protéines issus de la bio-ingénierie. Avec un peu de chance, ces efforts ouvriront la voie à un avenir plus sain et plus durable.
Plus d'informations : Thuc Toan Pham et al, Affichage d'une cage à protéines sur un cristal de protéine par In-Cell Crystal Engineering, Nano Letters (2023). DOI :10.1021/acs.nanolett.3c02117
Fourni par l'Institut de technologie de Tokyo