Crédit :Université de Harvard
Alors que les scientifiques ont sondé les mystères de la vie à des échelles de plus en plus petites, ils ont inventé des outils pour les aider à comprendre ce qu'ils observent. La détermination de l'identité des molécules d'ADN et d'ARN est devenue monnaie courante grâce au développement commercial des technologies de séquençage de nouvelle génération, mais il n'en va pas encore de même pour les protéines, qui sont des acteurs d'une importance cruciale dans presque tous les processus biologiques. Les protéines sont beaucoup plus complexes que l'ADN et l'ARN, et sont souvent modifiées chimiquement, ce qui rend l'objectif d'identifier facilement des protéines uniques dans un échantillon (protéomique à molécule unique) difficile à atteindre.
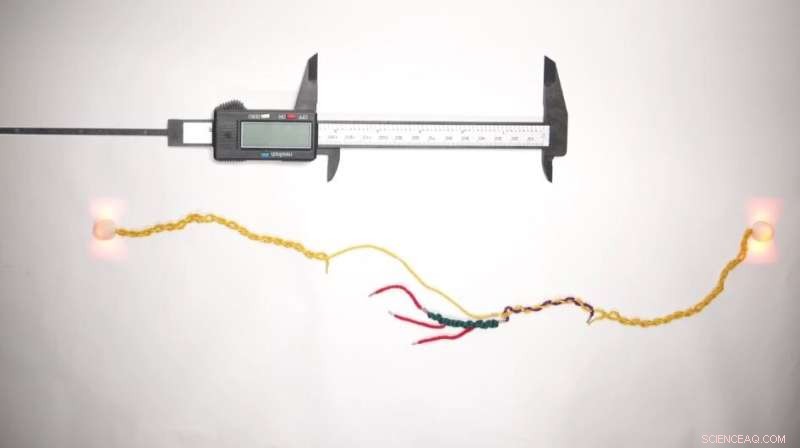
Aujourd'hui, des scientifiques travaillant à la Molecular Robotics Initiative au sein de l'Institut Wyss de l'Université de Harvard, de l'Institut Blavatnik de la Harvard Medical School (HMS) et du Boston Children's Hospital (BCH) ont utilisé l'ADN, l'élément fondamental de la vie elle-même, pour créer ce qui peut soyez la plus petite règle au monde pour mesurer les protéines.
Baptisée "DNA Nanoswitch Calipers" (DNC), cette technologie permet aux chercheurs d'effectuer des mesures de distance sur des peptides uniques (les éléments constitutifs des protéines) avec une grande précision en appliquant de petites quantités de force. En effectuant rapidement de nombreuses mesures de distance sur la même molécule, DNC crée une "empreinte digitale" unique qui peut être utilisée pour l'identifier dans des expériences ultérieures. La réalisation est rapportée dans Nanotechnologie de la nature .
"Lorsque vous essayez de comprendre quelque chose en biologie, il existe deux principales méthodes d'enquête :vous pouvez observer votre sujet dans son état naturel, ou vous pouvez le perturber et voir comment il réagit. Les observations peuvent fournir de nombreuses informations biologiques intéressantes, mais parfois, la meilleure façon d'apprendre quelque chose est d'interagir physiquement avec lui », a déclaré l'auteur co-correspondant Wesley Wong, Ph.D., membre associé du corps professoral à l'Institut Wyss et professeur agrégé au HMS qui est également chercheur au BCH. . "Déterminer le modèle d'acides aminés au sein d'une molécule peptidique en appliquant la force est un nouveau paradigme dans la recherche scientifique en cours de techniques qui nous permettront de séquencer des protéines aussi facilement que nous séquençons actuellement l'ADN."
Utiliser la force
DNC est basé sur la technologie sous-jacente du nanocommutateur d'ADN :un seul brin d'ADN auquel sont attachées des "poignées" moléculaires en plusieurs points sur sa longueur. Lorsque deux de ces poignées se lient l'une à l'autre, elles créent une boucle dans le brin d'ADN et la longueur totale du brin est raccourcie. Lorsqu'une force est appliquée pour écarter les poignées, le brin reprend sa longueur d'origine. La différence entre la longueur du brin dans ses états bouclé et non bouclé reflète la taille de la boucle, et donc la distance entre les poignées.
L'équipe de recherche s'est rendu compte qu'ils pouvaient pousser les nanocommutateurs à ADN un peu plus loin :s'ils concevaient plutôt les poignées pour qu'elles se lient à une biomolécule, les poignées pourraient effectivement « pincer » la molécule entre elles comme les deux pointes d'un pied à coulisse, plutôt que de se lier l'une à l'autre. autre. En mesurant comment l'ajout de la molécule cible entre les poignées modifiait la longueur totale du nanocommutateur d'ADN dans ses états en boucle ou non, l'équipe a émis l'hypothèse qu'elle pouvait mesurer efficacement la taille de la molécule.
"D'une certaine manière, les nanocommutateurs à ADN exploitent l'une des méthodes mécaniques les plus classiques pour mesurer des objets :il suffit d'appliquer une force à quelque chose et de voir comment cela change en réponse", a déclaré le co-premier auteur Darren Yang, chercheur postdoctoral à l'Institut Wyss et BCH. "C'est une approche que nous n'avons pas vraiment vue utilisée dans le domaine de la protéomique à molécule unique, car appliquer une force à de si petits objets est incroyablement difficile. Mais nous étions à la hauteur du défi."
Pour concrétiser leur idée d'une nouvelle technique de mesure basée sur la force, Yang et ses collègues ont d'abord attaché deux types de poignées différentes à une molécule cible :une poignée "forte" pour ancrer fermement la molécule à une extrémité du DNC, et plusieurs poignées "faibles" qui pourraient se fixer à l'autre extrémité de la DNC. Ils ont ensuite attaché les deux extrémités du DNC à deux perles "piégées optiquement" suspendues dans des faisceaux laser. En rapprochant les billes, ils ont induit l'une des poignées faibles de la molécule cible à se lier au DNC, créant un état en boucle. Lorsqu'ils ont ensuite augmenté la force en éloignant les perles, la poignée faible a finalement libéré son lien, ramenant le DNC à son état plus long et non bouclé.
L'équipe a d'abord testé cette technique sur des molécules simples d'ADN simple brin (ssDNA) et a confirmé que le changement des mesures de distance entre l'état bouclé et non bouclé du DNC était directement corrélé à la longueur de la molécule cible. Ces changements de longueur pourraient être mesurés avec une précision de l'angström (c'est-à-dire dix fois plus petite que la largeur d'une double hélice d'ADN), permettant l'identification de changements de longueur aussi petits que ceux d'un seul nucléotide.
Étant donné que la molécule cible contient plusieurs poignées faibles qui peuvent se lier au DNC, des cycles répétés de liaison et de rupture de ces poignées créent une série de mesures de distance entre la poignée forte et les poignées faibles qui sont uniques à chaque molécule mesurée. Cette "empreinte digitale" peut être utilisée pour identifier une molécule connue dans un échantillon ou pour déduire des informations structurelles sur une molécule inconnue.
Sonder les protéines
Après avoir confirmé que le DNC pouvait mesurer de manière fiable la taille des molécules d'ADN, les chercheurs se sont concentrés sur leur véritable objectif :les protéines. Ils ont conçu un peptide synthétique (une courte chaîne d'acides aminés) avec une longueur et une séquence connues et ont répété l'expérience, en l'attachant à une extrémité du DNC via la poignée solide et attacher et rompre à plusieurs reprises les liens entre ses poignées faibles et le DNC en appliquant différentes quantités de force. Ils ont découvert que toutes les distances mesurées par leur outil entre les poignées fortes et faibles correspondaient aux distances attendues en fonction de la longueur du DNC et des longueurs des acides aminés dans le peptide. Ils ont également obtenu des résultats similaires lorsqu'ils ont utilisé le DNC pour mesurer un peptide linéarisé naturel appelé NOXA BH3.
Ce processus a également généré des empreintes digitales de mesure uniques pour chaque peptide. L'équipe a créé un modèle informatique pour prédire combien de protéines humaines pourraient être identifiées de manière unique à l'aide de cette méthode, et a constaté que plus de 75 % des protéines dans une base de données de protéines couramment utilisée pouvaient être identifiées via empreintes digitales avec une probabilité d'au moins 90 %.
"Nous avons en fait été quelque peu surpris par l'efficacité de cette technique", a déclaré le co-premier auteur Prakash Shrestha, Ph.D., boursier postdoctoral à l'Institut Wyss et au BCH. "Les pincettes optiques existent depuis des décennies et le cycle de l'ADN entre un état bouclé et non bouclé existe depuis environ 10 ans, et nous n'étions pas sûrs de pouvoir obtenir des mesures suffisamment haute résolution en combinant ces idées. Mais il s'est avéré que ces empreintes digitales sont très efficaces pour identifier les protéines."
L'identification de molécules de protéines uniques est un exploit impressionnant en soi, mais être capable de le faire pour plusieurs protéines simultanément est le véritable Saint Graal pour la protéomique à molécule unique. L'équipe a en outre démontré qu'en remplaçant les billes optiques par un système de pince magnétique, elle était capable d'effectuer des mesures sur plusieurs peptides différents en parallèle, ainsi que de déterminer les concentrations relatives de différentes molécules.
"La protéomique à molécule unique est encore en grande partie une chimère en raison des défis de mise à l'échelle et de résolution. Notre travail actuel montre que l'empreinte digitale de séquence basée sur la force a le potentiel de réaliser ce rêve", a déclaré l'auteur co-correspondant William Shih, Ph.D. , membre principal du corps professoral du Wyss Institute et professeur au HMS et au Dana-Farber Cancer Institute. "Notre ambition ultime est de lire efficacement non seulement les séquences protéiques, mais également les structures protéiques à haut débit."
La prochaine étape des scientifiques vers cet objectif consiste à valider leurs étriers pour des mesures structurelles à faible force sur les protéines repliées et leurs complexes, en étudiant leur utilisation potentielle pour la biologie structurelle et la protéomique. Ils travaillent également à augmenter le débit de la technologie pour accélérer encore l'analyse d'échantillons mixtes.
"Cette recherche intègre la biophysique moléculaire avec la nanotechnologie de pointe de l'ADN mise au point ici à l'Institut Wyss pour nous permettre d'interagir avec et d'analyser des molécules biologiques d'une manière vraiment nouvelle. Lorsque William et Wesley ont posé cette idée pour la première fois comme un défi central pour le nouveau Molecular Robotics Initiative, cela ressemblait vraiment à de la science-fiction, mais c'est précisément le type de projet que nous voulons entreprendre au Wyss. Je suis très fier de l'équipe qui a fait de cette technologie une réalité, elle a le potentiel de changer totalement comment nous faisons de la science et développons des thérapies », a déclaré le directeur fondateur de Wyss, Don Ingber, M.D., Ph.D., qui est également professeur Judah Folkman de biologie vasculaire à la Harvard Medical School et au BCH, et professeur de bioingénierie à la Harvard John A. Paulson School of Engineering and Applied Sciences. Démocratiser l'analyse de force à molécule unique à haut débit