Il existe une lutte constante pour réduire les sources d’énergie basées sur le carbone et les remplacer par des alternatives faibles ou sans carbone. Le processus de division de l'eau pourrait être la solution.
La production d’hydrogène est une méthode simple, sûre et efficace pour produire plus d’énergie que l’essence ne peut le faire par le simple processus de division de l’eau. Récupérer l’énergie de cette manière, au lieu de dépendre fortement (ou pas du tout) des sources d’énergie à base de carbone, devient de plus en plus la norme. Les chercheurs ont trouvé une méthode permettant d'utiliser des sulfures de métaux de transition, comme l'étain (Sn), le cobalt (Co) et le fer (Fe) sur de la mousse de nickel, pour développer des électrocatalyseurs à métaux non précieux destinés à être utilisés dans une division de l'eau rentable et respectueuse de l'environnement.
Les chercheurs ont publié leurs résultats dans Nano Research Energy .
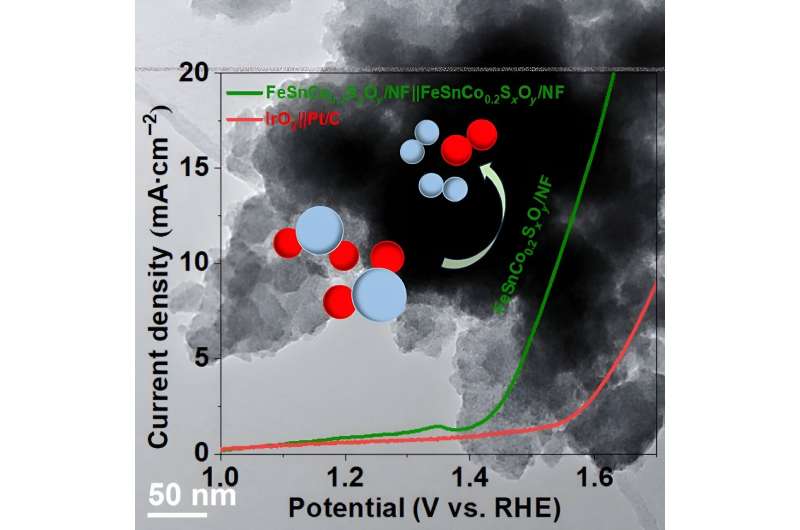
Pour réussir cette entreprise de réduction du carbone, certaines réactions doivent être stabilisées pour ce processus. La star de l'étude est FeSnCo0.2 Sx Oo /NF, qui peut agir à la fois comme anode et cathode dans le processus de division de l'eau à basse tension.
Les deux réactions préoccupantes ici sont les réactions de dégagement d’oxygène (OER) et les réactions de dégagement d’hydrogène (HER). Les REL génèrent O2 via une réaction chimique à partir de l’eau. HER donne H2 à partir d’une réaction de transfert de deux électrons. Le H2 résultant est utile comme carburant. L’utilisation de ces deux réactions est idéale pour créer un électrocatalyseur bifonctionnel. Les électrocatalyseurs peuvent être définis comme des catalyseurs (ou démarreurs de réaction) qui fonctionnent sur les surfaces des électrodes, qui sont des surfaces pouvant transporter un courant électrique.
HER s'est avéré stable après 55 heures d'utilisation continue et nécessite également un surpotentiel inférieur à celui des OER. Le surpotentiel est la différence dans la quantité d'énergie nécessaire au fonctionnement d'un catalyseur donné.
Malheureusement, la stabilité des REL n’est pas là où elle devrait être. Cela est dû en partie à l’étape supplémentaire impliquée dans le transfert d’électrons, mais également au fait que les électrolytes sous lesquels ils fonctionnent sont généralement agressifs. Bien que les REL soient stables avec une utilisation continue d'environ 70 heures, leur activité diminue avec une teneur en cobalt plus élevée.
"Il est essentiel d'améliorer la stabilité des sulfures de métaux de transition dans le cadre des REL afin qu'ils puissent être utilisés comme catalyseurs bifonctionnels HER et REL pour les piles à combustible réversibles à hydrogène", a déclaré Jingqi Guan, auteur et chercheur de l'étude.
OER a également un surpotentiel plus élevé que HER. Avec une plus grande quantité d'énergie nécessaire pour faire fonctionner le catalyseur, les REL peuvent être plus « difficiles ». Cependant, la combinaison de fer, d'étain et de cobalt sur la mousse de nickel présente une certaine amélioration de la stabilité bifonctionnelle et de l'activité HER et OER.
La combinaison de ces métaux et des interfaces hétérostructurales formées peut ajuster la répartition des électrons à travers la surface de l’électrolyte. « Hétérostructural » fait ici référence à un semi-conducteur qui peut avoir une composition chimique modifiée en fonction de la position dans laquelle se trouvent les deux produits chimiques. Dans ce cas, il s'agit d'un duo sulfure/oxyhydroxyde.
Une distribution uniforme des électrons contribue à augmenter le taux de transfert de charge dans toute la structure, ce qui favorise ensuite le transfert d'électrons. En raison de la nature de ce semi-conducteur, une stabilité accrue améliorerait naturellement l'activité et la fonction globales.
Dans l’ensemble, ces métaux de transition ont un effet synergique les uns sur les autres, notamment lorsqu’ils subissent une HER. Cet effet en fait des candidats idéaux pour relever le principal défi proposé par les chercheurs :réduire les sources d'énergie basées sur le carbone.
Bien que les résultats soient très prometteurs, il est toujours possible de prendre des mesures à l’avenir pour perfectionner un processus. Trouver un catalyseur qui minimise les surpotentiels peut réduire l’apport d’énergie nécessaire pour catalyser la réaction. De plus, s'assurer que les électrocatalyseurs développés sont suffisamment durables pour être utilisés commercialement et qu'ils peuvent supporter de longues heures d'utilisation continue sans aucun effet néfaste est impératif pour le succès à long terme des interfaces hétérostructurelles.
Plus d'informations : Siyu Chen et al, Ingénierie d'interface d'un électrocatalyseur hétérostructural sulfure/oxyhydroxyde de Fe-Sn-Co pour la division synergique de l'eau, Nano Research Energy (2023). DOI :10.26599/NRE.2023.9120106
Fourni par Tsinghua University Press