Dans une étude publiée dans Clinical and Translational Medicine , un groupe de recherche de l'Université de Nanjing a évalué les effets sur cible et hors cible du système d'administration de siARN auto-assemblé.
La thérapie par interférence ARN (ARNi) implique l’administration de petits ARN interférents (ARNsi) vers des cellules cibles pour obtenir des effets thérapeutiques. Bien que le siARN présente une liaison spécifique au gène cible pour des effets ciblés, il peut également interagir avec des gènes non ciblés, entraînant des effets hors cible. Ainsi, l'un des principaux défis de la thérapie ARNi réside dans l'obtention d'un équilibre entre les effets ciblés et non ciblés afin d'améliorer l'impact souhaité sur la cible tout en minimisant le risque hors cible associé.
Le groupe de recherche de l'Université de Nanjing, composé de Chen-Yu Zhang et Xi Chen, a développé une approche unique de délivrance de siARN en reprogrammant le foie hôte pour synthétiser des siARN auto-assemblés encapsulés dans de petites vésicules extracellulaires (sEV) pour les délivrer à des tissus spécifiques afin de traiter diverses maladies.
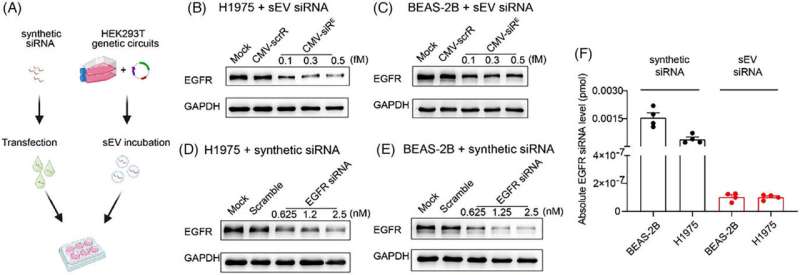
Dans cette étude, les auteurs ont étudié plus en détail les effets sur cible et hors cible du système de délivrance de siARN auto-assemblé, en relevant les défis de la délivrance de siARN in vivo et en mettant en évidence son potentiel thérapeutique et sa biosécurité. Ils ont souligné la puissance supérieure des siARN auto-assemblés pour faire taire des cibles spécifiques par rapport aux siARN synthétiques.
L'analyse transcriptomique a en outre confirmé des effets minimes hors cible dans les tissus normaux et des effets anti-EGFR significatifs dans les cellules tumorales in vivo. Dans l'ensemble, l'étude fournit des informations prometteuses sur l'efficacité thérapeutique et les effets secondaires du système de délivrance d'ARNsi auto-assemblé in vivo.
Cette étude a dévoilé l’efficacité impressionnante du siARN auto-assemblé encapsulé dans le sEV, qui a présenté une interférence puissante sur la protéine EGFR avec seulement 1/2 000 000 de la quantité de transfection synthétique. Cette révélation indique que les siARN encapsulés par le sEV traités de manière endogène fonctionnent de manière transparente dans les cellules réceptrices à des niveaux physiologiques, tandis que l'accumulation de niveaux supraphysiologiques de siARN synthétiques dans les cellules normales peut provoquer une cytotoxicité.
Par conséquent, la stratégie d'administration de siARN auto-assemblés in vivo est non seulement efficace à une concentration de siARN assez faible dans les cellules tumorales, mais présente également une meilleure biosécurité pour les cellules somatiques que les siARN synthétiques.
L’activité hors cible des siARN peut conduire à des phénotypes imprévus et compromettre les avantages thérapeutiques des siARN. Cette étude a méticuleusement évalué les risques hors cible des siARN EGFR auto-assemblés in vivo grâce au séquençage transcriptomique.
Aucun enrichissement statistiquement significatif pour des correspondances parfaites entre la région de graine du siARN EGFR et les 3'-UTR des transcrits régulés négativement n'a été observé dans les tissus normaux. Dans le tissu tumoral, l'analyse de l'enrichissement de l'ontologie génique (GO) a révélé que la plupart des principaux termes GO étaient étroitement associés à la signalisation EGFR. Les données indiquent que les effets non ciblés dans les tissus normaux sont minimes par rapport aux effets ciblés observés dans les cellules tumorales.
Concernant les risques potentiels associés à la saturation de la machinerie endogène des miARN par des siARN exogènes, l'analyse des gènes cibles de miR-122 après le traitement in vivo des siARN auto-assemblés n'a révélé que 13 changements significatifs parmi 1 566 cibles potentielles.
La majorité des cibles miR-122 présentaient des modèles d’expression similaires à ceux du groupe non traité. Ces données indiquent que les siARN EGFR auto-assemblés in vivo sont présents à des niveaux physiologiques appropriés et ont peu de chance de provoquer une hépatotoxicité par des perturbations dans les voies intrinsèques des miARN.
Dans l'ensemble, cette étude ouvre une nouvelle direction pour la thérapie par ARNi, ayant des implications significatives pour l'adoption clinique du système de délivrance d'ARNsi à auto-assemblage in vivo.
Contrairement à la thérapie génique conventionnelle, cette méthode démontre une spécificité élevée avec des risques hors cible minimes et aucun effet secondaire toxique. De plus, l'étude offre de nouvelles perspectives pour évaluer les effets secondaires établis et non établis dans le développement de thérapies siARN in vivo pour divers gènes.
Plus d'informations : Hongyuan Guo et al, Évaluation des effets sur cible et hors cible du petit système de délivrance d'ARN interférent du récepteur du facteur de croissance épidermique auto-assemblé, Médecine clinique et translationnelle (2024). DOI : 10.1002/ctm2.1579
Fourni par l'École des sciences de la vie de l'Université de Nanjing