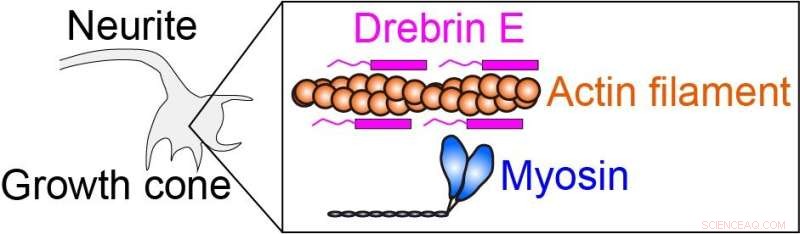
La force intracellulaire est produite par la myosine interagissant avec le filament d'actine (filament protéique). La drébrine E peut inhiber l'interaction actine-myosine, donc réguler la force intracellulaire. Il est connu que la concentration de drebrine E diminue au cours du développement de l'animal. Cependant, une corrélation entre la concentration de drebrine et l'activité actine-myosine est restée incertaine, en particulier à la température physiologique. Crédit :Hiroaki Kubota et al.
Un degré Celsius peut faire la différence :une équipe de chercheurs dirigée par l'Université d'Osaka a démontré la régulation d'un complexe protéique critique qui ne se produit qu'à température physiologique.
Pour étudier les fonctions des protéines, les chercheurs examinent les protéines purifiées in vitro. De telles expériences sont généralement limitées à des températures inférieures à la température physiologique pour éviter les dommages thermiques aux protéines. L'équipe a surmonté ce problème en appliquant un chauffage contrôlé optiquement avec un laser infrarouge pulsé. "Avec cette méthode, les protéines peuvent être chauffées jusqu'à 40 degrés Celsius sans aucun dommage pour les protéines", explique l'auteur principal Hiroaki Kubota, "ce qui nous permet d'examiner comment les protéines agissent à leur température physiologique."
Les chercheurs ont appliqué cette méthode de chauffage pour étudier le complexe d'actomyosine. La génération de force d'actomyosine, qui résulte de l'interaction entre les moteurs moléculaires de la myosine et les filaments d'actine, est un processus crucial régissant la motilité et la morphologie cellulaire. Il a été démontré que la protéine drebrine E inhibe ces interactions, mais son mécanisme de régulation n'est pas clair. Pour clarifier le rôle de la drebrine E, l'équipe a appliqué un chauffage microscopique à l'actomyosine en présence de drebrine et a observé la motilité produite par la génération de force d'actomyosine sur une plage allant de la température ambiante à la température physiologique.
Les chercheurs ont découvert que l'inhibition de la motilité de l'actomyosine par la drebrine E est éliminée immédiatement et de manière réversible lors du chauffage, en fonction de la concentration de la drebrine E. Lorsque la température augmente, l'inhibition de la motilité de l'actomyosine par la drebrine E diminue. L'équipe a également découvert que l'inhibition réduite n'est pas uniquement causée par la dissociation de la drebrine E de l'actine. Au lieu de cela, la drebrine E liée régule de manière coopérative l'activité de l'actomyosine, probablement en modifiant la structure de l'actine.
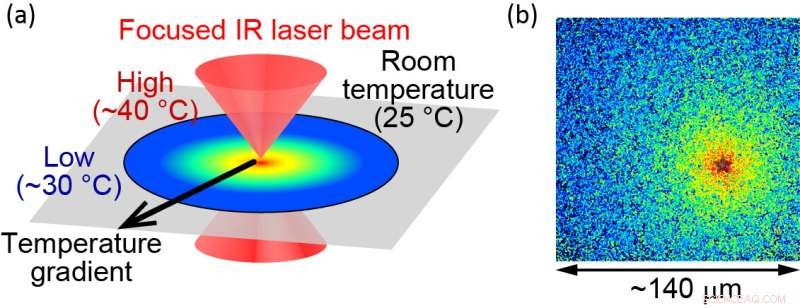
(a) Illustration de la méthode de chauffage microscopique à commande optique. (b) La température localisée est visualisée à l'aide de molécules fluorescentes. La source de chaleur est située au niveau de « l'étoile », où la température est mesurée à environ 40 °C. La fin du champ de vision est d'environ 30 °C. La taille du champ de vision est d'environ 140 μm. Crédit :Hiroaki Kubota et al.
Fait intéressant, en dessous de la température physiologique, la motilité de l'actomyosine montre une décroissance progressive avec l'augmentation de la concentration de drebrine E. Pourtant, entre 36,5 degrés Celsius et 37,5 degrés Celsius, le comportement change et la drebrine E présente un comportement d'inhibition de type interrupteur. La motilité n'est pas affectée par la concentration de drebrine E jusqu'à ce qu'un seuil soit atteint, ce qui entraîne immédiatement une inhibition. Leurs résultats suggèrent que la concentration seuil est similaire aux concentrations physiologiques de drebrine E précédemment signalées.
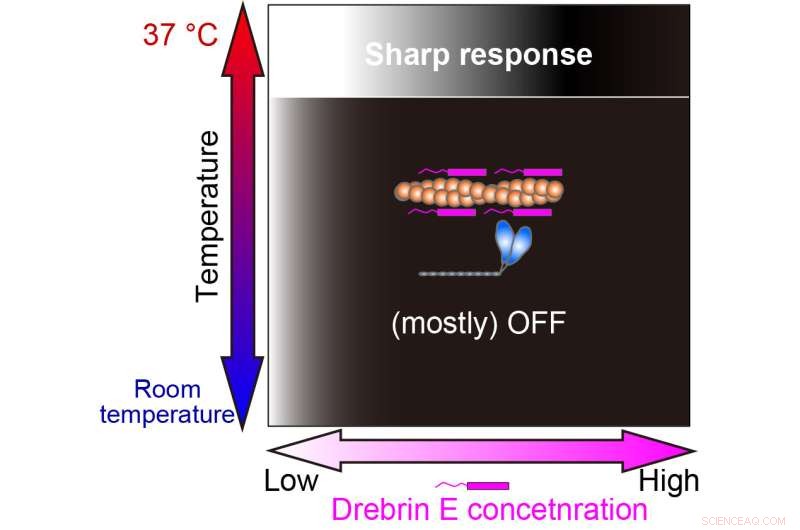
Notre étude a révélé que la régulation de l'interaction actine-myosine par la drebrine E n'est efficace qu'à la température physiologique (37°C). La gradation blanc-noir représente la production de force On (blanc) et Off (noir). Crédit :Hiroaki Kubota et al.
Cette régulation de la drebrine E en fonction de la température est remarquable et a de nombreuses implications pour les études futures. "Ces résultats suggèrent l'importance pour les mammifères enceintes de maintenir la température corporelle appropriée pour assurer le développement précis d'un embryon", explique Madoka Suzuki, auteur principal. De plus, en acquérant une compréhension précise des mécanismes de la machinerie de détection de température cellulaire, nous pourrons peut-être innover dans le développement de capteurs de température artificiels à l'échelle nanométrique.
L'article "Le contrôle microscopique de la température révèle une régulation coopérative de l'interaction actine-myosine par la drebrine E" a été publié dans Nano Letters . Formation de cicatrice contrôlée dans le cerveau