Crédit :Ecole Polytechnique Fédérale de Lausanne
En combinant deux méthodes de microscopie, les chercheurs de l'EPFL sont capables de voir simultanément ce qui se passe à l'intérieur d'une cellule et sur sa membrane, donnant un aperçu sans précédent des processus cellulaires qui se produisent lors d'une infection, par exemple.
Les cellules sont le composant fondamental des organismes vivants et sont l'hôte d'un certain nombre de phénomènes biologiques complexes. Les chercheurs doivent être capables d'étudier ces phénomènes en détail afin de comprendre certains types de troubles et de maladies, puis de développer des traitements efficaces. Mais observer efficacement les cellules vivantes à l'échelle micro ou nano reste un défi. En combinant deux méthodes de microscopie différentes, des chercheurs de l'EPFL de deux laboratoires différents ont développé conjointement un système permettant d'observer les cellules vivantes en action avec une précision inégalée. Leurs découvertes apparaissent dans deux articles :l'un publié dans Nature Communications en juillet et l'autre publié aujourd'hui dans ACS Nano .
"Les méthodes actuellement disponibles présentent de nombreux défis techniques pour observer des cellules vivantes à un niveau aussi granulaire", explique Georg Fantner, responsable du Laboratoire de bio- et nano-instrumentation (LBNI) de l'EPFL. « Des techniques telles que la microscopie électronique permettent une résolution inégalée de la surface cellulaire à l'échelle nanométrique, mais elles nécessitent de placer des échantillons sous vide et de les bombarder d'électrons. Les organismes vivants ne peuvent tout simplement pas survivre à ce type de traitement. Une autre méthode courante est la microscopie à fluorescence. vous observez des échantillons sans les détruire, avoir une résolution suffisante pour résoudre la surface tridimensionnelle de la cellule est difficile. De plus, la dose de photons requise peut endommager les cellules."
Les chercheurs de l'EPFL ont donc décidé de combiner deux microscopies complémentaires pour observer la surface cellulaire et l'activité moléculaire à l'intérieur, peu invasives pour les cellules vivantes. Ils ont couplé l'imagerie par fluctuation optique stochastique (SOFI), qui peut être utilisée pour visualiser les molécules ciblées et les phénomènes se produisant à l'intérieur des cellules, avec la microscopie à sonde à balayage (ou, plus précisément, la microscopie à conductance ionique à balayage - SICM). La microscopie à sonde à balayage consiste généralement à toucher directement un échantillon cellulaire avec une pointe de sonde afin de révéler sa surface et de cartographier sa topographie. Cependant, le contact mécanique entre l'échantillon et la pointe est préjudiciable à l'observation des cellules vivantes car il perturbe l'état natif des cellules. L'équipe de l'EPFL a donc développé un microscope où la sonde physique est remplacée par un nanopore de verre qui mesure le flux d'ions pour détecter la surface cellulaire sans contact.
Tout est une question d'interaction
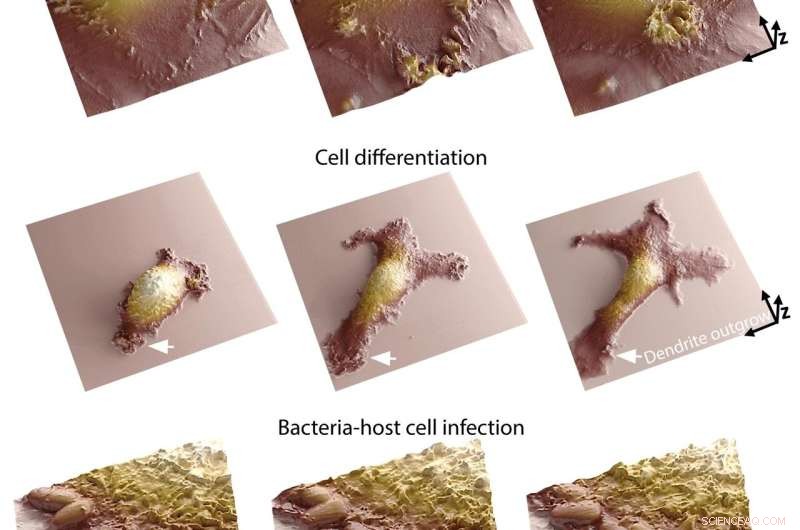
La combinaison de ces deux méthodes ouvre la voie à des observations scientifiques sans précédent. Alors que la microscopie à fluorescence donne aux chercheurs un aperçu de l'intérieur des cellules individuelles, la microscopie à conductance ionique à balayage leur permet de générer des images topographiques 3D des membranes cellulaires. Le système de l'EPFL permet donc aux chercheurs de visualiser à la fois l'intérieur et l'extérieur des cellules, ce qui leur donne un aperçu précieux des liens entre les phénomènes se produisant simultanément à ces deux endroits différents.
"La membrane d'une cellule est l'endroit où elle interagit avec son environnement", explique Samuel Mendes Leitão, Ph.D. étudiant au LBNI qui a développé le microscope SICM. "C'est là que se produisent de nombreux processus biologiques et changements morphologiques, comme lors d'une infection cellulaire. Notre système permet aux chercheurs d'analyser les arrangements moléculaires à l'intérieur de la cellule et de cartographier leur corrélation avec la dynamique membranaire. De plus, nous pouvons désormais suivre ces dynamiques de manière très détaillée pour le temps. des plages allant de moins d'une seconde à quelques jours. Être capable d'imager en continu à l'échelle nanométrique pendant de longues périodes est l'un des principaux défis de la microscopie de cellules vivantes, car les cellules sont très sensibles aux petites perturbations."
Qualité d'image améliorée
Vytautas Navikas, un doctorat. étudiant au Laboratoire de biologie à l'échelle nanométrique (LBEN) de l'EPFL, a développé les composants optiques du système :"Un autre avantage de la combinaison des deux méthodes est qu'elle améliore incroyablement la qualité de l'image. Nous pouvons désormais observer les processus cellulaires avec une résolution beaucoup plus élevée."
L'équipe de l'EPFL estime que leur système, qui peut être utilisé pour observer des phénomènes tels que la motilité cellulaire, la différenciation et la communication cellule-cellule, ouvre de nombreuses nouvelles voies de recherche. Cela pourrait être extrêmement utile en biologie des infections, en immunologie et en neurobiologie, des domaines où il est important de comprendre comment une cellule réagit en temps réel à un stimulus extérieur.
Cette étude est également un bon exemple du type de percée qui peut se produire lorsque des chercheurs de deux laboratoires différents de l'EPFL entrent en contact et mettent en commun leur expertise dans la poursuite d'un objectif commun. Un regard sur les cellules vivantes jusqu'aux molécules individuelles