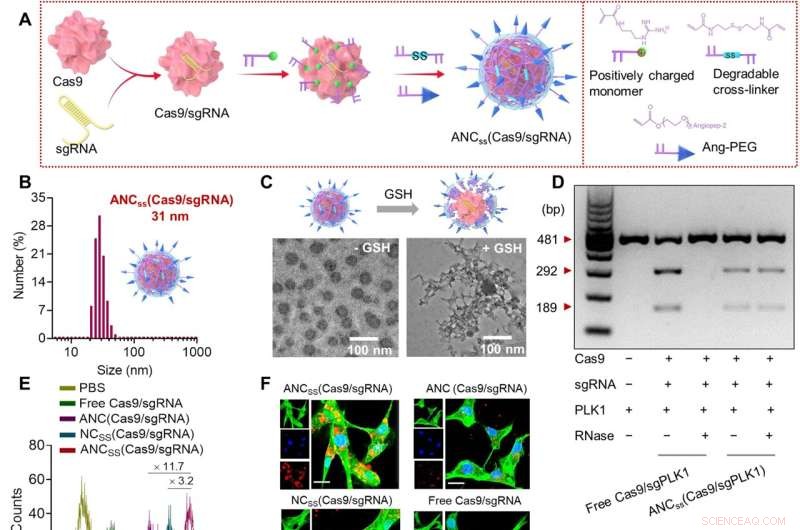
Fabrication, propriétés physiques et fonction cellulaire des nanocapsules Cas9/sgRNA. ( A ) La polymérisation radicalaire in situ a été utilisée pour synthétiser des nanocapsules réticulées au disulfure contenant Cas9 / sgRNA et fonctionnalisées avec le ligand de ciblage angiopep-2. (B) Répartition de la taille des ANCSS (Cas9/sgRNA) nanocapsules déterminées par diffusion dynamique de la lumière. (C) Images TEM d'ANCSS (Cas9/sgRNA) avec ou sans traitement GSH. (D) Analyse par électrophorèse sur gel de l'ANCSS (Cas9/sgPLK1) ou Cas9/sgPLK1 libre avec ou sans traitement RNase (1 mg/ml, 30 min). (E) Cytométrie en flux des cellules U87MG après incubation de 4 heures avec ANCSS (Cas9/sgRNA) ou contrôles. (F) Images de microscopie confocale à balayage laser (CLSM) de cellules U87MG après incubation de 4 heures avec ANCSS (Cas9/sgRNA) ou contrôles. Cas9 a été étiqueté avec Alexa Fluor 647 (AF647; rouge); le cytosquelette a été coloré avec Alexa Fluor 488 (vert) et les noyaux ont été colorés avec Hoechst 33342 (bleu). Pour (E) et (F), la concentration d'AF647-Cas9 était de 20 nM. Barres d'échelle, 20 μm. (G) Efficacité de l'édition du gène de la luciférase dans les cellules U87MG-Luc incubées avec ANCSS (Cas9/sgRNA) ou contrôles pendant 72 heures. Les données sont présentées sous forme de moyennes ± SD (n =5; *P <0,05, **P <0,01 et ***P <0,001). (H) Indels du gène PLK1 dans les cellules U87MG transfectées avec ANCSS (Cas9/sgPLK1) ou contrôles pendant 48 heures. (I) Schéma de l'édition de gènes dans le noyau. (J) Niveaux d'expression de PLK1 dans les cellules U87MG après 72 heures d'incubation avec ANCSS (Cas9/sgPLK1) ou contrôles. (K) Test d'apoptose des cellules U87MG après 72 heures d'incubation avec ANCSS (Cas9/sgRNA) et d'autres contrôles. Pour (G) à (K), la concentration de Cas9 était de 20 nM. pb, paires de bases; PBS, solution saline tamponnée au phosphate. Crédit :Progrès scientifiques (2022). DOI :10.1126/sciadv.abm8011
Une équipe internationale de chercheurs a développé une nanocapsule capable de traverser la barrière hémato-encéphalique (BBB) pour transporter l'outil d'édition CRISPR-Cas9 pour traiter une tumeur cérébrale. Dans leur article publié dans la revue Science Advances, le groupe décrit comment ils ont créé leur capsule et à quel point cela a fonctionné lorsqu'ils ont été testés sur des souris atteintes d'un glioblastome.
Les glioblastomes sont notoirement difficiles à traiter. Les tumeurs apparaissent dans le cerveau et leur croissance endommage les tissus. Les options de traitement comprennent l'ablation chirurgicale, les injections directes de thérapies destinées à tuer les cellules cancéreuses ou l'insertion de virus CRISPR dans la circulation sanguine. Chacune de ces options a un inconvénient, du tissu cérébral endommagé à l'inefficacité due aux difficultés avec les thérapies traversant la BHE. Dans ce nouvel effort, les chercheurs ont essayé une nouvelle approche, en utilisant une nanocapsule pour transporter l'outil d'édition CRISPR-Cas9 jusqu'à la tumeur cérébrale où il cible un gène responsable du développement de nouvelles cellules - une capsule capable de traversant la BBB.
L'enveloppe de la nanocapsule a été créée à l'aide d'un polymère réticulé disulfure qui a ensuite été parsemé d'un peptide angiopep-2. Le peptide a été ajouté pour créer une charge de surface neutre afin qu'il ne soit pas attaqué par la ribonucléase. La coque était juste assez grande pour contenir un complexe Cas9 mais toujours assez petite (environ 30 nanomètres de long) pour lui permettre de traverser la BHE.
Les chercheurs ont testé leur système de délivrance de nanocapsules dans des modèles murins de glioblastome. Chacun a reçu une seule injection dans la queue - certains ont reçu le nouveau système d'administration de nanocapsules tandis que d'autres ont reçu un contrôle. Les chercheurs ont découvert que les souris ayant reçu la nouvelle thérapie avaient un temps de survie moyen de 68 jours contre 24 jours pour le groupe témoin. Ils ont également trouvé un taux de mutation génétique indésirable inférieur à 0,5 % dans d'autres tissus cérébraux.
Les chercheurs suggèrent que leur travail représente une nouvelle étape vers des approches non invasives et non virales pour le traitement des glioblastomes, bien qu'ils reconnaissent que beaucoup plus de travail doit être fait avant de pouvoir déterminer si la même approche sera à la fois sûre et efficace chez l'homme.
© 2022 Réseau Science X De minuscules capsules offrent une alternative à l'administration virale de la thérapie génique