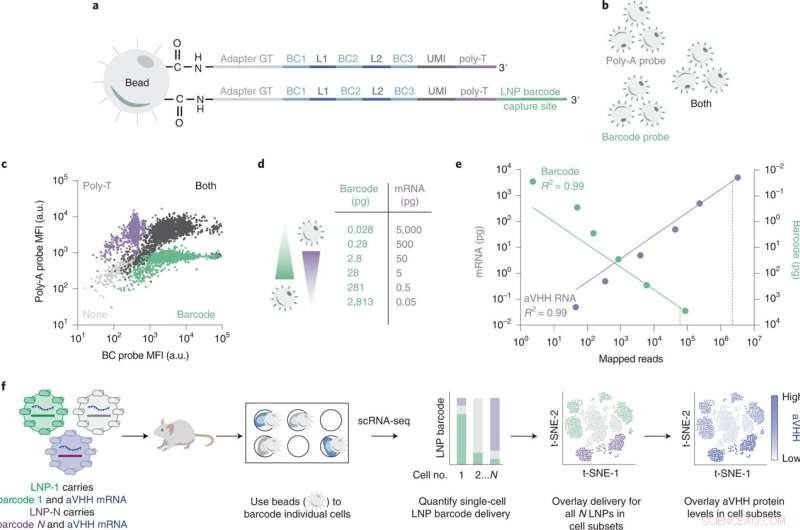
SENT-seq utilise des séquences de capture orthogonales pour générer des lectures multiomiques accordables. Crédit :Nanotechnologie de la nature (2022). DOI :10.1038/s41565-022-01146-9
Les thérapeutiques basées sur l'ARN messager, ou ARNm, peuvent potentiellement traiter un large éventail de maladies, y compris le cancer, les maladies génétiques et, comme le monde l'a appris ces dernières années, les virus mortels.
Pour fonctionner, ces médicaments doivent être administrés directement aux cellules cibles dans des bulles de graisse à l'échelle nanométrique appelées nanoparticules lipidiques, ou LNP - l'ARNm n'est pas très bon s'il n'atteint pas le bon type de cellule.
Une équipe de chercheurs du Georgia Institute of Technology et de la faculté de médecine de l'Université Emory a fait un pas de plus vers l'amélioration du développement de ces véhicules de livraison sur mesure, en rendant compte de leurs travaux le 30 juin dans Nature Nanotechnology . Curtis Dobrowolski et Kalina Paunovska, stagiaires dans le laboratoire de James Dahlman, ont développé un système pour rendre les études précliniques sur les nanoparticules plus prédictives. Leurs découvertes influencent déjà l'orientation de la recherche dans ce domaine concurrentiel en pleine croissance.
"Je suis très enthousiasmé par cette étude et je prévois de transférer la plupart de nos futurs projets vers cette méthodologie", a déclaré Dahlman, professeur agrégé et professeur de début de carrière de la Fondation McCamish au département Wallace H. Coulter de génie biomédical de Georgia Tech et Emory.
Séquencement des événements
Au cours des dernières années, Dahlman s'est associé au professeur Coulter BME Philip Santangelo dans une entreprise de recherche très active. Le laboratoire de Santangelo développe des thérapies par ARNm, et le laboratoire de Dahlman les propose à l'aide de LNP.
Pour accélérer le processus de test de l'efficacité de leurs TNL, l'équipe de Dahlman a développé une technique appelée code-barres ADN. Dans ce processus, les chercheurs insèrent un fragment d'ADN qui correspond à un LNP donné. Les LNP sont ensuite injectés et les cellules sont ensuite examinées pour la présence des "codes à barres" en utilisant le séquençage génétique. Le système identifie quels codes-barres ont atteint quelles cibles spécifiques, mettant en évidence les nanoparticules les plus prometteuses. Étant donné que de nombreuses séquences d'ADN peuvent être lues à la fois, le processus de codage à barres permet de réaliser de nombreuses expériences simultanément, accélérant ainsi la découverte de supports de nanoparticules lipidiques efficaces.
Le code-barres de l'ADN a considérablement amélioré le processus de criblage préclinique des nanoparticules. Mais il existe toujours un obstacle important à l'administration des médicaments. En raison de leur diversité, les cellules sont un peu comme des cibles mouvantes. Dahlman a noté que les cellules que l'on croyait auparavant homogènes sont composées de sous-ensembles cellulaires distincts et variés. Son équipe a supposé que cette hétérogénéité chimique et génétique avait une forte influence sur la capacité des LNP à administrer des thérapies par ARNm dans les cellules.
"Les cellules n'ont pas qu'une seule protéine qui les définit - elles sont compliquées", a déclaré Dahlman. "Ils peuvent être définis par une combinaison de choses, et si nous sommes honnêtes, ils sont mieux définis en utilisant tous les gènes qu'ils expriment ou non."
Pour tester leur hypothèse, les chercheurs ont développé un nouvel outil pour mesurer toutes ces choses à la fois. Leur système de livraison de nanoparticules multiomiques est appelé séquençage de ciblage de nanoparticules unicellulaires, ou SENT-seq.
Approche multiomique
En utilisant SENT-seq, les chercheurs ont pu quantifier comment les LNP délivrent des codes-barres d'ADN et de l'ARNm dans les cellules, la production ultérieure de protéines facilitée par le médicament à base d'ARNm, ainsi que l'identité de la cellule, dans des milliers de cellules individuelles.
Cette approche multiomique pourrait représenter un bond en avant important pour la découverte de TNL à haut débit. La technique SENT-seq a permis à l'équipe d'identifier les sous-types cellulaires qui démontrent une absorption particulièrement élevée ou faible des nanoparticules, ainsi que les gènes associés à ces sous-types.
Ainsi, en plus de tester l'efficacité d'un médicament et la réaction de certains sous-types cellulaires aux nanoparticules, ils identifient les gènes impliqués dans l'absorption réussie des LNP. Et ils font tout en même temps.
"Les données suggèrent que ces différents sous-ensembles de cellules ont des réponses distinctes aux nanoparticules qui influencent le fonctionnement d'une thérapie par ARNm", a déclaré Dahlman. "Il reste encore beaucoup de travail à faire, mais nous pensons que la capacité de lire simultanément l'administration de nanoparticules à haut débit et la réponse cellulaire aux nanoparticules conduira à de meilleures thérapies d'ARNm."
La co-auteure principale Paunovska a déclaré qu'elle et Dobrowolski avaient eu l'idée du système SENT-seq, "de manière organique, après deux mois de collaboration".
Dahlman added:"I'm proud of the work that Curtis, Kalina, and the team did in the lab. I think this is the beginning of an extremely interesting phase in our work." New system speeds screening of drug-delivering nanoparticles