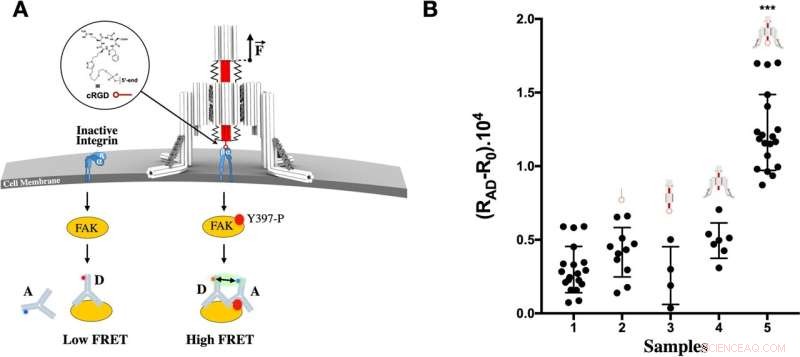
Activation autonome par nano-treuil d'ADN de la signalisation des intégrines. A L'intégrine du récepteur transmembranaire (bleu) existe sous la forme d'un hétérodimère αβ compact. Les intégrines transmettent des contraintes mécaniques appliquées, entre 1 et 15 pN, et recrutent des protéines supplémentaires pour assembler des adhérences focales, notamment Focal Adhesion Kinase (FAK), qui devient phosphorylée au résidu Y397 après stimulation mécanique de l'intégrine. L'addition de deux anticorps avec des marqueurs donneur, D, et accepteur, A, permet la détection de FAK phosphorylé dans un test LRET. Les deux anticorps se lient au FAK phosphorylé (Y397-P) provoquant un signal LRET élevé détectable, alors qu'un seul anticorps se lie en l'absence de phosphorylation, produisant un signal LRET faible. Les cellules B MCF-7 en suspension étaient 1, témoins laissés non traités, 2, incubées avec un oligonucléotide conjugué RGD, 3, incubées avec un origami piston-cylindre fonctionnalisé cRGD, 4, incubées avec des nano-treuils non fonctionnalisés, 5, incubées avec un cRGD fonctionnalisé Nano-treuil. Les cellules ont ensuite été lysées et FAK phosphorylée. Le signal de fond, R0 , d'anticorps seuls a été soustrait du signal des cellules lysées dans des conditions expérimentales et de contrôle calculées à partir des rapports d'intensités de fluorescence de l'accepteur et du donneur, RAD . Les résultats sont la moyenne d'au moins trois expériences indépendantes. Les barres d'erreur représentent l'écart type, la signification statistique a été déterminée par une analyse unidirectionnelle de la variance par rapport au témoin non traité (*** P < 0,001). Crédit :Nature Communications (2022). DOI :10.1038/s41467-022-30745-2, https://www.nature.com/articles/s41467-022-30745-2
Construire un petit robot à partir d'ADN et l'utiliser pour étudier des processus cellulaires invisibles à l'œil nu... On vous pardonnerait de penser que c'est de la science-fiction, mais c'est en fait l'objet de recherches sérieuses par des scientifiques de l'Inserm, du CNRS et Université de Montpellier au Centre de Biologie Structurale de Montpellier. Ce "nano-robot" très innovant devrait permettre d'étudier de plus près les forces mécaniques appliquées à l'échelle microscopique, cruciales pour de nombreux processus biologiques et pathologiques. Il est décrit dans une nouvelle étude publiée dans Nature Communications .
Nos cellules sont soumises à des forces mécaniques exercées à l'échelle microscopique, déclenchant des signaux biologiques indispensables à de nombreux processus cellulaires impliqués dans le fonctionnement normal de notre organisme ou dans le développement de maladies.
Par exemple, la sensation du toucher est en partie conditionnée à l'application de forces mécaniques sur des récepteurs cellulaires spécifiques (dont la découverte a été cette année récompensée par le prix Nobel de physiologie ou médecine). Outre le toucher, ces récepteurs sensibles aux forces mécaniques (appelés mécanorécepteurs) permettent de réguler d'autres processus biologiques clés comme la constriction des vaisseaux sanguins, la perception de la douleur, la respiration ou encore la détection des ondes sonores dans l'oreille, etc.
Le dysfonctionnement de cette mécanosensibilité cellulaire est impliqué dans de nombreuses maladies, par exemple le cancer :les cellules cancéreuses migrent à l'intérieur de l'organisme en sonnant et en s'adaptant en permanence aux propriétés mécaniques de leur microenvironnement. Une telle adaptation n'est possible que parce que des forces spécifiques sont détectées par des mécanorécepteurs qui transmettent l'information au cytosquelette cellulaire.
A l'heure actuelle, nos connaissances sur ces mécanismes moléculaires impliqués dans la mécanosensibilité cellulaire sont encore très limitées. Plusieurs technologies sont déjà disponibles pour appliquer des forces contrôlées et étudier ces mécanismes, mais elles présentent un certain nombre de limites. En particulier, ils sont très coûteux et ne permettent pas d'étudier plusieurs récepteurs cellulaires à la fois, ce qui rend leur utilisation très chronophage si l'on veut collecter beaucoup de données.
Structures origami ADN
Afin de proposer une alternative, l'équipe de recherche dirigée par le chercheur Inserm Gaëtan Bellot au Centre de biologie structurale (Inserm/CNRS/Université de Montpellier) a décidé d'utiliser la méthode de l'origami ADN. Cela permet l'auto-assemblage de nanostructures 3D sous une forme prédéfinie en utilisant la molécule d'ADN comme matériau de construction. Au cours des dix dernières années, la technique a permis des avancées majeures dans le domaine des nanotechnologies.
Cela a permis aux chercheurs de concevoir un "nano-robot" composé de trois structures d'origami d'ADN. De taille nanométrique, il est donc compatible avec la taille d'une cellule humaine. Il permet pour la première fois d'appliquer et de contrôler une force avec une résolution de 1 piconewton, soit un trillionième de Newton, 1 Newton correspondant à la force d'un doigt cliquant sur un stylo. C'est la première fois qu'un objet à base d'ADN fabriqué par l'homme et auto-assemblé peut appliquer une force avec cette précision.
L'équipe a commencé par coupler le robot à une molécule qui reconnaît un mécanorécepteur. Cela a permis de diriger le robot vers certaines de nos cellules et d'appliquer spécifiquement des forces sur des mécanorécepteurs ciblés localisés à la surface des cellules afin de les activer.
Un tel outil est très précieux pour la recherche fondamentale, car il pourrait être utilisé pour mieux comprendre les mécanismes moléculaires impliqués dans la mécanosensibilité cellulaire et découvrir de nouveaux récepteurs cellulaires sensibles aux forces mécaniques. Grâce au robot, les scientifiques pourront également étudier plus précisément à quel moment, lors de l'application de la force, les voies de signalisation clés de nombreux processus biologiques et pathologiques sont activées au niveau cellulaire.
« La conception d'un robot permettant l'application in vitro et in vivo des forces piconewton répond à une demande croissante de la communauté scientifique et représente une avancée technologique majeure. Cependant, la biocompatibilité du robot peut être considérée à la fois comme un avantage pour les applications in vivo mais peut également représenter une faiblesse avec la sensibilité aux enzymes qui peuvent dégrader l'ADN. Notre prochaine étape sera donc d'étudier comment nous pouvons modifier la surface du robot afin qu'il soit moins sensible à l'action des enzymes. Nous essaierons également de trouver d'autres modes d'activation de notre robot à l'aide, par exemple, d'un champ magnétique », explique Bellot. Ce que les forces mécaniques derrière le repliement des protéines peuvent nous dire sur le cancer métastatique