Une nouvelle méthode à haute résolution développée par une équipe internationale de scientifiques comprenant Robert Tampé et Ralph Wieneke de l'Université Goethe de Francfort permet désormais pour la première fois l'identification et la quantification précises des interactions d'un récepteur avec deux ligands simultanément. Crédit :GU
Les processus de signalisation dans les organismes sont régis par des interactions extracellulaires et intracellulaires spécifiques et impliquent des centaines de récepteurs fonctionnels très polyvalents différents situés dans les membranes cellulaires. Pour les scientifiques souhaitant comprendre les processus de signalisation, la situation est rendue plus complexe par le fait que les récepteurs sont non seulement inégalement répartis et souvent capables de se lier à plus d'un ligand, mais aussi par le même type de récepteur pouvant se lier fortement à un ligand, faiblement ou pas tous. De nouvelles méthodes permettant des quantifications précises de ces interactions complexes sont requises de toute urgence.
Une nouvelle méthode à haute résolution développée par une équipe internationale de scientifiques comprenant Robert Tampé et Ralph Wieneke de l'Université Goethe de Francfort permet désormais pour la première fois l'identification et la quantification précises des interactions d'un récepteur avec deux ligands simultanément. La nouvelle méthode a été publiée dans la dernière édition de la revue Communication Nature .
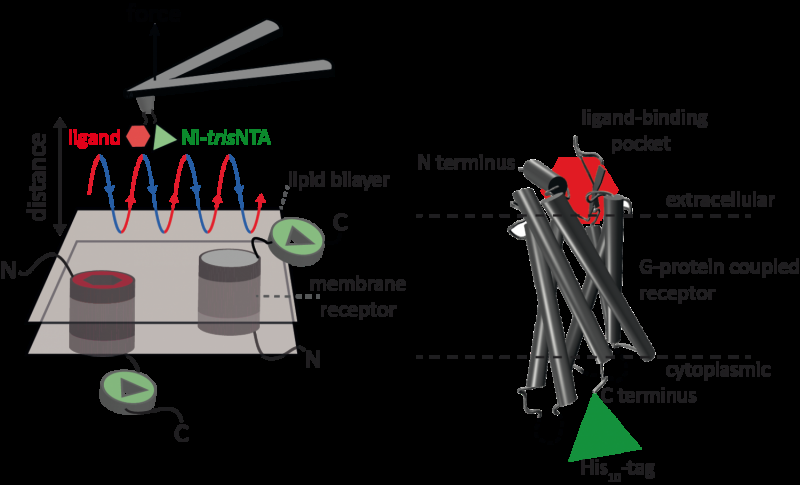
La microscopie à force atomique (AFM) est une technique puissante pour la caractérisation à l'échelle nanométrique des surfaces. Il utilise un cantilever avec une pointe extrêmement fine. La microscopie à force atomique basée sur la courbe force-distance (AFM basée sur FD) combine l'imagerie haute résolution et la spectroscopie de force à molécule unique. Dans les études utilisant des échantillons biologiques, la pointe de l'AFM s'approche et se rétracte de l'échantillon pour chaque pixel. Les méthodes AFM basées sur FD utilisent différents revêtements de la pointe AFM comme boîte à outils et ces méthodes ont fait des progrès impressionnants ces dernières années. Pour la détection de sites de liaison spécifiques, l'AFM à base de FD nécessite l'attache d'un ligand à la pointe de l'AFM. Tout en contournant les complexes protéiques dans une membrane, ces pointes AFM fonctionnalisées peuvent alors mesurer les interactions du ligand captif avec la protéine. Il n'avait pas été possible d'imager des récepteurs à membrane unique et de détecter simultanément leurs interactions avec plus d'un ligand, mais la nouvelle méthode a surmonté cet obstacle.
Pour leur preuve de principe, les scientifiques ont utilisé le récepteur 1 activé par la protéase humaine (PAR1), fait partie de la grande famille des récepteurs membranaires couplés aux protéines G. Les GPCR assurent la médiation de la plupart des réponses cellulaires aux hormones et aux neurotransmetteurs, en plus d'être responsable de la vision, olfactif et gustatif. Les GPCR peuvent coexister dans différents états fonctionnels dans la membrane cellulaire et peuvent lier divers ligands à différentes forces ou affinités. Le GPCR PAR1 est activé par la thrombine protéase de coagulation qui déclenche des cascades de signalisation pour initier des réponses cellulaires qui aident à orchestrer l'hémostase, thrombose, l'inflammation et peut-être aussi la réparation des tissus. À l'aide de leur nouvelle méthode AFM basée sur la FD, le PAR1 humain dans les protéoliposomes a pu être imagé tout en détectant simultanément les interactions extracellulaires et intracellulaires de PAR1 avec deux ligands. La chimie de surface et la méthode nanoscopique développées sont applicables à une gamme de systèmes biologiques in vitro et in vivo.