
Les chercheurs ont assemblé trois nanostructures d'ADN distinctes, comprenant une structure en forme de C et deux structures en forme de tonneau, et ont montré par microscopie électronique à transmission qu'ils étaient protégés par leur stratégie combinée de revêtement et de réticulation. Crédit :Institut Wyss de l'Université Harvard
Vaincre le cancer et une pléthore d'autres maladies ne dépend pas seulement de l'obtention des bons médicaments, il s'agit également de les amener aux bons endroits dans le corps, tout en minimisant les dommages aux tissus sains. Les nanostructures d'ADN telles que l'origami d'ADN auto-assemblé qui se plie en des formes définies sont des véhicules prometteurs pour l'administration de médicaments et de diagnostics, et différentes stratégies de vaccination. En effet, ils peuvent être fonctionnalisés de manière flexible avec des médicaments à petites molécules et à base de protéines, et des antigènes immunogènes, ainsi que des caractéristiques qui facilitent leur livraison à des cellules et tissus cibles spécifiques. En outre, ils sont biocompatibles et biodégradables.
Le grand potentiel des nanostructures d'ADN pour diverses applications biomédicales, cependant, est toujours entravée par leur stabilité limitée dans les tissus et le sang du corps. William Shih, doctorat et son équipe ont maintenant conçu un efficace, et une approche de réticulation chimique évolutive qui peut fournir aux nanostructures d'ADN la stabilité dont elles ont besoin en tant que véhicules d'administration pour les médicaments et les diagnostics. Leur étude est publiée dans le Journal de l'American Chemical Society ( JACS ).
« Pour aider à réaliser l'extraordinaire promesse des nanostructures d'ADN, nous avons développé une approche chimique largement applicable pour augmenter leur résistance à la dégradation, " a déclaré William Shih, un membre du corps professoral de l'Institut Wyss qui dirige le projet de l'Initiative de robotique moléculaire de l'Institut. "En modifiant les nanostructures d'ADN en deux étapes simples, nous pouvons considérablement améliorer leur survie, qui supprime un goulot d'étranglement central dans la traduction de ces nanodispositifs en solutions à une variété de problèmes médicaux. »
Les origami d'ADN sont généralement assemblés à partir d'un long brin d'ADN qui se replie en une forme 3D définie à l'échelle du nanomètre à l'aide de plusieurs brins courts reliant différentes parties de la structure dans l'espace. Le squelette de l'ADN est fortement chargé négativement, ce qui signifie que rapprocher les différentes parties des brins de pliage à proximité les uns des autres peut être problématique car ils se repoussent naturellement, semblable aux surfaces négatives de deux aimants. Pour vaincre ces forces répulsives, les chercheurs ajoutent généralement un excès d'ions chargés positivement comme les ions magnésium (Mg
Souvent, cependant, le magnésium ajouté
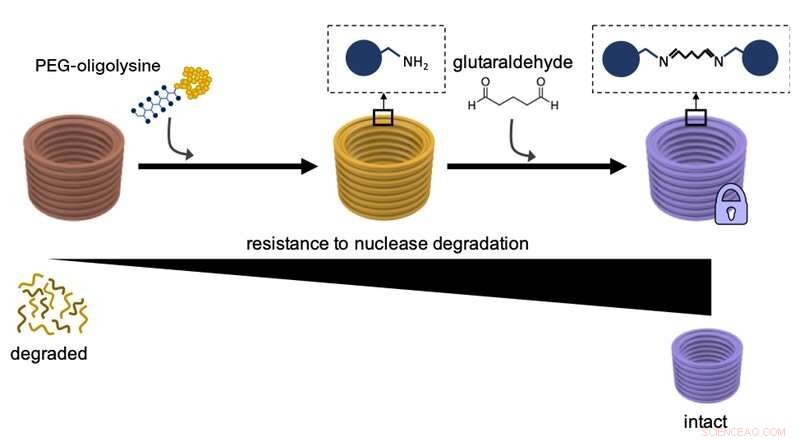
Ce schéma explique comment revêtir d'abord des nanostructures d'ADN avec des PEG-oligolysines, puis la réticulation chimique de PEG-oligolysines distinctes avec du glutaraldéhyde en tant qu'agent de réticulation augmente leur résistance à la dégradation par les enzymes ADN nucléase et leur stabilité globale. Crédit :Institut Wyss de l'Université Harvard
Dans une étude précédente, Shih et son équipe ont trouvé un moyen de surmonter le besoin de Mg excessif
Contrairement au Mg individuel
« En utilisant cette stratégie simple, nous pourrions étendre la survie des nanostructures d'ADN d'environ 400 fois avec des demi-vies allant jusqu'à 36 heures dans des environnements physiologiques contenant également des niveaux de nucléase normaux, " a déclaré la première auteur Frances Anastassacos, Doctorat., qui au moment de l'étude était un étudiant diplômé travaillant avec Shih. "Toutefois, cela était encore en deçà de ce qui est nécessaire dans certaines applications thérapeutiques réelles. L'oligolysine pégylée avait encore tendance à se détacher de l'ADN dans une certaine mesure."
Dans le JACS étudier, l'équipe a maintenant résolu cette partie restante du "problème de stabilité". "Nous avons essentiellement noué des nœuds supplémentaires dans le réseau électrostatique à l'aide d'un réactif de réticulation chimique connu sous le nom de" glutaraldéhyde " qui lie fortement les oligolysines pégylées distinctes à la surface des nanostructures d'ADN, " a déclaré Anastassacos. " En présence de niveaux d'ADN nucléase qui dépassent de loin ceux du corps humain, leur survie s'étendait au-delà de 300 heures. L'augmentation de 400 fois de la stabilité que nous avons observée avec l'oligolysine pégylée seule a été augmentée d'un autre 250 fois, qui fait mouche pour les applications cliniques."
D'autres tentatives qui ont réussi à stabiliser les nanostructures d'ADN avec des modifications chimiques reposaient principalement sur la refonte des structures existantes afin que des sites spécifiques au sein de leurs structures 3-D deviennent accessibles à la chimie déployée. En revanche, "notre approche peut être réalisée sur n'importe quelle nanostructure d'ADN, et sa facilité et sa rentabilité pourraient renforcer considérablement la traduction de nombreuses structures thérapeutiques et diagnostiques déjà existantes et nouvellement conçues, " dit Zhao Zhao, Doctorat., qui est co-premier auteur de l'étude et ancien boursier postdoctoral de l'équipe de Shih.
Dans leur étude, Shih et son équipe visaient à maximiser la stabilité des nanostructures d'ADN. Les chercheurs, cependant, pense qu'en variant davantage l'étape de réticulation, la demi-vie des structures pourrait être adaptée à des applications spécifiques qui nécessitent que les molécules de cargaison deviennent disponibles à différents moments et sur différents intervalles de temps. Ils ont déjà découvert que leur méthode de protection n'interférait pas avec la liaison des molécules cargo aux structures modifiées et l'absorption des structures par les cellules humaines en culture. Maintenant, la traduction clinique peut commencer.