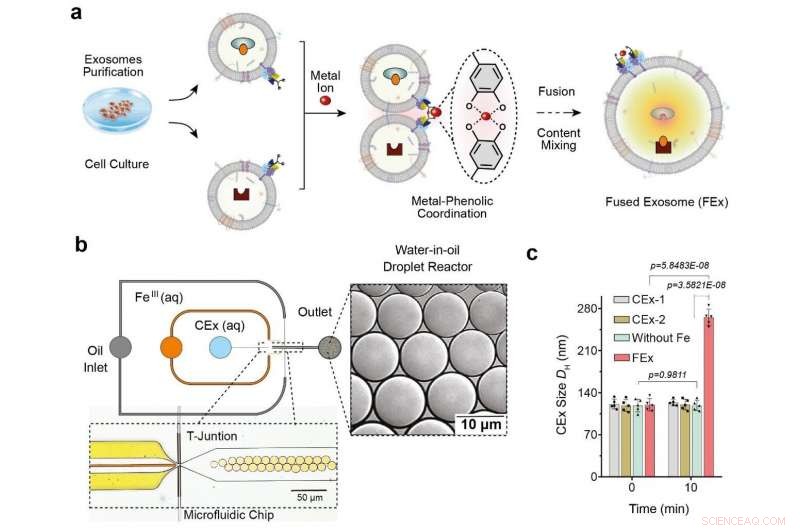
(a) L'ion Fe3+ déclenche la fusion membranaire dans les exosomes adaptés avec du catéchol (CEx). La formation d'un complexe métal-catéchol rapproche les exosomes et permet la fusion. Différents réactifs dans chaque exosome sont ensuite encapsulés ensemble, favorisant le mélange et le déclenchement de réactions à l'intérieur des exosomes fusionnés (FEx). (b) Le dispositif microfluidique conçu pour générer des réacteurs à gouttelettes d'eau dans l'huile à la jonction de focalisation du flux. Les deux phases aqueuses (CEx et sel métallique) se rencontrent et sont livrées dans le flux d'huile (1% de tensioactif PFPE-PEG dans le FC-40) pour briser le liquide en gouttelettes. (c) Taille moyenne des exosomes non fusionnés (CEx-1 :121 ± 8 nm, CEx-2 :123 ± 5 nm) et des exosomes fusionnés (FEx :265 ± 14 nm). Crédit : Institut des sciences fondamentales
Les cellules ont de petits compartiments appelés organites qui effectuent des réactions biochimiques complexes. Ces compartiments ont plusieurs enzymes qui travaillent ensemble pour exécuter des fonctions cellulaires importantes. Des chercheurs du Center for Soft and Living Matter au sein de l'Institute for Basic Science (IBS, Corée du Sud) ont réussi à imiter ces compartiments spatiaux à l'échelle nanométrique pour créer des « mitochondries artificielles ». L'étude est publiée dans Catalyse naturelle comme article de couverture. Les chercheurs déclarent que la technologie peut être utilisée pour construire des organites artificiels qui peuvent fournir de l'ATP ou d'autres molécules utiles aux cellules des tissus endommagés ou malades.
Ceci a été réalisé grâce à la reprogrammation des exosomes, qui sont de petites vésicules (diamètre ~ 120 nm) que les cellules utilisent pour la signalisation intercellulaire. Les chercheurs ont réalisé les expériences en utilisant des réacteurs à gouttelettes microfluidiques, qui a généré de petites gouttelettes de taille similaire à celle des cellules typiques. (diamètre ~10 m) Les chercheurs ont d'abord cherché à faciliter la fusion contrôlée de ces exosomes au sein des gouttelettes tout en empêchant les fusions indésirables.
Ils y sont parvenus en adaptant les surfaces des exosomes avec des molécules appelées catéchol, qui est un agent chélatant qui forme des complexes avec des ions métalliques. Cela a été fait en fixant le catéchol sur des anticorps qui ciblent des marqueurs cellulaires spécifiques, tels que CD9. La propriété de formation de complexes du catéchol leur permet de provoquer des fusions entre les exosomes lorsqu'ils sont mélangés à des ions métalliques tels que Fe 3+ . La fusion membranaire se produit lorsque les catéchols sur les surfaces se lient au fer et rapprochent les vésicules les unes des autres.
Les chercheurs ont d'abord testé l'efficacité de ce système en chargeant un type d'exosomes avec de la calcéine-Co 2+ et un autre avec EDTA. Lorsque les deux vésicules fusionnent et que le contenu est mélangé, EDTA s'empare de la Co 2+ loin de la calcéine, ce qui permet alors à ce dernier de devenir fluorescent. L'équipe s'est rendu compte qu'elle avait réussi à détecter le signal de fluorescence, et la fusion a en outre été confirmée par le doublement du diamètre de l'exosome mesuré.
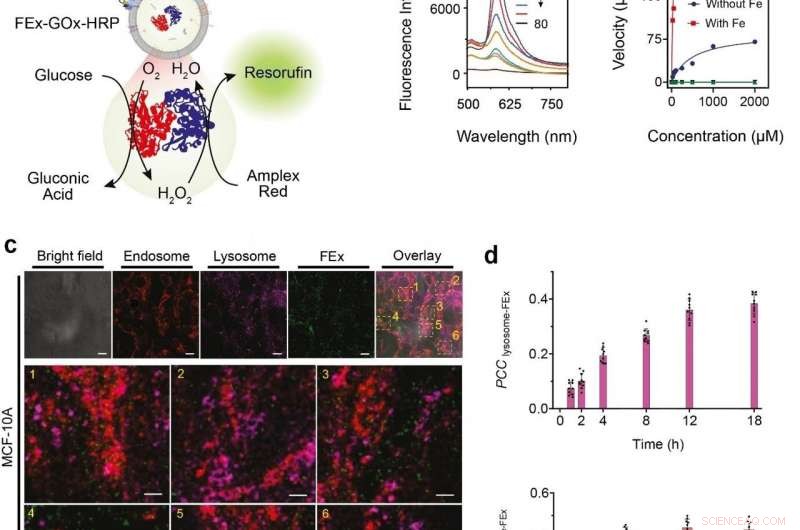
(a) Représentation schématique d'un CEx à deux enzymes GOx/HRP fusionnant en FEx. La réaction catalytique a été initiée en ajoutant du glucose, génération de H2O2 par oxydation aérobie, qui a ensuite été utilisé pour oxyder Amplex Red pour générer de la résorufine. (b) Spectres de fluorescence représentatifs de la résorufine générés par biocatalyse dans des exosomes fusionnés (FEx-GOx-HRP) à différents moments. Taux de réaction du nanoréacteur en fonction de la concentration en glucose pour calculer les constantes cinétiques en ajustant l'équation de Michaelis-Menten. (c) Stabilité et intégrité de FEx-GOx-HRP après intégration cellulaire après 48 h. Endosomes (EEA1, rouge) lysosomes (LAMP1, magenta), et FEx (vert) sont affichés. (d) Tracé des valeurs du coefficient de corrélation de Pearson (PCCLysosome-FEx) au fil du temps pour la fluorescence magenta (lysosome) et verte (FEx), et pour la fluorescence rouge (Endosome) et verte (FEx). Crédit : Institut des sciences fondamentales
Ces exosomes personnalisés ont ensuite été préchargés avec différents réactifs et enzymes, qui les ont transformés en nano-usines biomimétiques. Cela leur permet de produire des biomolécules de grande valeur en effectuant les transformations biocatalytiques souhaitées d'une manière confinée dans l'espace, ce qui n'est pas possible avec des tubes à essai de laboratoire conventionnels. L'équipe a démontré cette fonction de cascade biocatalytique multienzymatique en encapsulant de la glucose oxydase (GOx) et de la peroxydase de raifort (HRP) à l'intérieur des exosomes. Le GOx convertit d'abord le glucose en acide gluconique et en peroxyde d'hydrogène. Le HRP utilise à son tour le peroxyde d'hydrogène généré dans la première réaction pour oxyder Amplex Red en un produit fluorescent, résorufine. Les chercheurs ont même pu aller plus loin en ajoutant une troisième enzyme, galactosidase qui transforme le lactose en glucose, dans le mélange.
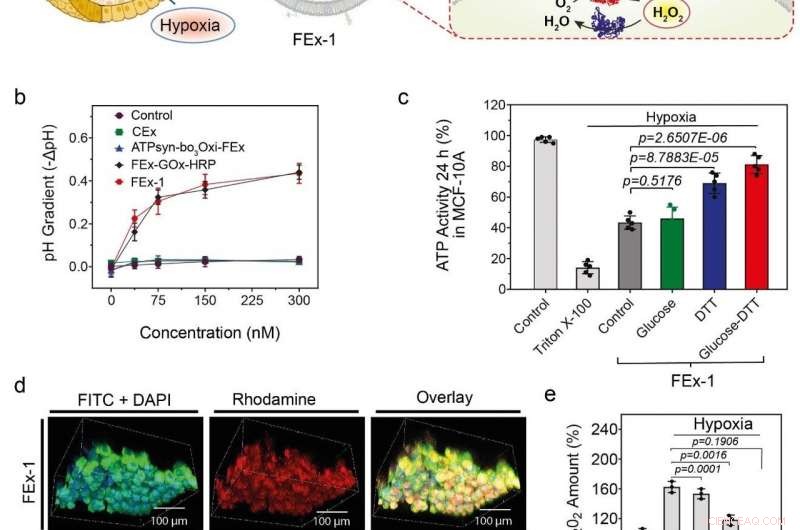
(a) Assemblage d'organites artificiels pour la production d'énergie. L'ATP synthase a été reconstituée en CEx-GOx et la bo3 oxydase a été reconstituée en CEx-HRP. Les deux CEx ont été fusionnés et ont pu pénétrer profondément dans les sphéroïdes. (b) Diminution du pH (-ΔpH) par rapport aux concentrations de glucose pour différents exosomes. Les exosomes fusionnés montrent un degré plus élevé de diminution du pH. (c) Modifications de la production d'ATP après absorption de FEx-1 dans différentes conditions. (d) Les organites artificiels ont pu pénétrer profondément dans le sphéroïde. La rangée du haut montre FEx-1 (marqué en rouge avec de la rhodamine B), tandis que la rangée du bas montre l'enzyme HRP libre à l'intérieur des sphéroïdes. (e) Les niveaux globaux de ROS ont diminué en soumettant FEx-1 sous glucose et DTT. Crédit : Institut des sciences fondamentales
Prochain, les chercheurs voulaient savoir exactement dans quelle mesure ces mini réacteurs peuvent être absorbés et internalisés par les cellules. Les cellules dérivées de tissus mammaires humains ont été nourries avec des nanoréacteurs d'exosomes fusionnés, et leur internalisation au cours des 48 heures suivantes a été observée à l'aide de divers marqueurs et d'un microscope confocal à balayage laser (CLSM). Il a été découvert que les cellules étaient capables d'absorber ces exosomes personnalisés principalement par endocytose, ainsi que de nombreux autres mécanismes. Ils ont en outre testé le système enzymatique GOx-HRP à deux dans les cellules, et il a été constaté que les exosomes fusionnés étaient capables de fabriquer avec succès des produits fluorescents même lorsqu'ils étaient à l'intérieur des cellules.
Armé de cette connaissance, l'équipe a cherché à créer des mitochondries artificielles fonctionnelles capables de produire de l'énergie à l'intérieur des cellules. Pour y parvenir, ATP synthase et bo
"Pris ensemble, nos résultats mettent en évidence le potentiel de ces exosomes en tant que nanoréacteurs dans la régulation de l'activité métabolique des cellules à l'intérieur des sphéroïdes, et en atténuant les dommages cellulaires dus à l'hypoxie, " note CHO Yoon-Kyoung, l'auteur correspondant de l'étude. On espère que d'autres recherches sur ces organites artificiels présenteront un nouveau paradigme dans divers domaines tels que le diagnostic et le traitement des maladies, biotechnologie, Médicament, et l'environnement.