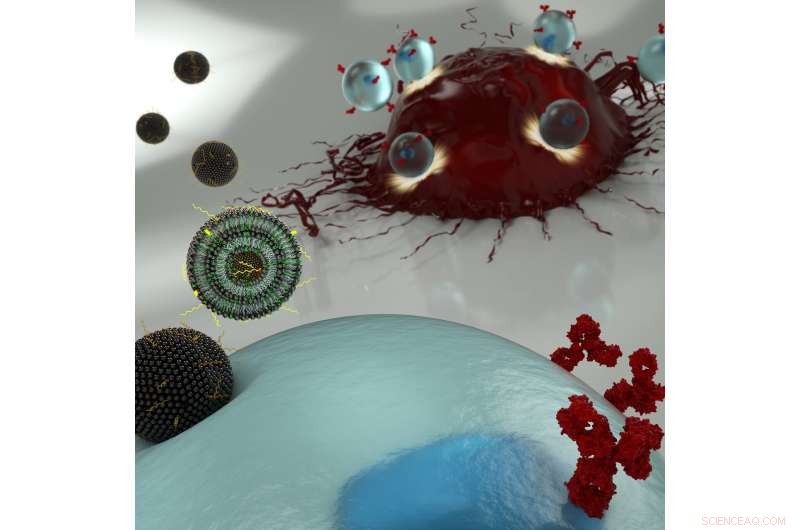
Une illustration d'artiste de nanoparticules transportant l'ARNm dans une cellule T (bleu), permettant à ces derniers d'exprimer des récepteurs de surface qui reconnaissent les cellules cancéreuses (rouge). Crédit :Ryan Allen, Studios Second Bay
Les nouvelles immunothérapies anticancéreuses consistent à extraire les cellules T d'un patient et à les modifier génétiquement afin qu'elles reconnaissent et attaquent les tumeurs. Cette technique est une véritable percée médicale, avec un nombre croissant de patients atteints de leucémie et de lymphome en rémission complète depuis que le traitement CAR T a été approuvé par la FDA en 2017.
Ce type de thérapie n'est pas sans défis, toutefois. L'ingénierie des cellules T d'un patient est laborieuse et coûteuse. Et en cas de succès, les altérations du système immunitaire rendent immédiatement les patients très malades pendant une courte période, avec des symptômes tels que fièvre, nausées et effets neurologiques.
Maintenant, Des chercheurs de l'Université de Pennsylvanie ont démontré une nouvelle technique d'ingénierie qui, car il est moins toxique pour les cellules T, pourrait permettre un mécanisme différent pour modifier la façon dont ils reconnaissent le cancer.
Les cours de traitement avec des cellules T qui utilisent ce mécanisme pourraient avoir moins d'effets secondaires pour les patients.
La nouvelle technique d'ingénierie des chercheurs consiste à transporter l'ARN messager (ARNm) à travers la membrane de la cellule T via une nanoparticule à base de lipides, plutôt que d'utiliser un virus VIH modifié pour réécrire l'ADN de la cellule. Il serait préférable d'utiliser la première approche, car il ne confère qu'un changement temporaire au système immunitaire du patient, mais la méthode standard actuelle pour faire passer l'ARNm au-delà de la membrane cellulaire peut être trop toxique pour être utilisée sur le nombre limité de cellules T pouvant être extraites d'un patient.
Les chercheurs ont démontré leur technique dans une étude publiée dans la revue Lettres nano . Il était dirigé par Michael Mitchell, Skirkanich Professeur adjoint d'innovation au Département de bio-ingénierie de la Penn's School of Engineering and Applied Science, et Margaret Billingsley, un étudiant diplômé dans son laboratoire.
Ils ont collaboré avec l'un des pionniers de la thérapie CAR T :Carl June, le professeur Richard W. Vague en immunothérapie et directeur du Center for Cellular Immunotherapies du Abramson Cancer Center et le directeur du Parker Institute for Cancer Immunotherapy de la Penn's Perelman School of Medicine.
La thérapie CAR T consiste à concevoir les propres cellules T d'un patient afin qu'elles expriment des récepteurs d'antigènes chimériques, le "CAR" de "CAR T, " sur leurs surfaces. Ces récepteurs permettent aux cellules T de reconnaître les cellules cancéreuses comme des envahisseurs étrangers et de les éliminer du corps. Les techniques d'ingénierie actuelles consistent à éliminer un certain nombre de cellules T d'un patient, réécrire leur ADN avec un virus pour qu'ils expriment ces CAR, puis les réinjecter au patient.
"Cette méthode d'ingénierie virale produit des cellules T à expression CAR permanente, mais cela entraîne de graves effets indésirables, car les cellules CAR T restent actives chez le patient même après l'éradication des cellules cancéreuses, " dit Billingsley. " En utilisant l'ARNm pour générer des cellules CAR T, cependant, crée des cellules T avec une expression CAR transitoire. Cela pourrait permettre aux cliniciens d'administrer des thérapies cellulaires CAR T à des doses pour cibler les cellules cancéreuses sans endommager autant de cellules saines dans le processus, atténuant ainsi les effets secondaires."
Une telle approche n'a pas encore gagné en traction clinique, car les méthodes pour introduire l'ARNm dans les cellules T sont encore limitées. La norme actuelle, électroporation, qui consiste à perforer la membrane cellulaire avec une impulsion électrique, n'est pas une option attrayante, car le processus hautement invasif présente un risque élevé de tuer la cellule T ou d'avoir un impact sur sa fonctionnalité. Même optimisé, l'électroporation entraîne souvent la mort cellulaire dans 50 pour cent des cellules au cours du processus de fabrication des cellules.
Vu le coût, difficulté et enjeux liés à l'acquisition de ces cellules chez un patient CAR T, une méthode beaucoup moins toxique d'introduction d'ARNm est nécessaire avant que cette technique ne soit une alternative viable à l'approche d'édition d'ADN.
Mitchell, Billingsley et leurs collègues ont donc entrepris de trouver une plate-forme de livraison appropriée pour faire passer l'ARNm au-delà de la membrane des cellules T en quantités suffisantes pour qu'ils soient traduits en protéines réceptrices souhaitées.
Cependant, comme les cellules T n'absorbent pas facilement le matériel de leur environnement, trouver la bonne nanoparticule pour cette application était un défi. Plus loin, il serait crucial que la plate-forme comprenne à la fois une administration hautement efficace et une faible cytotoxicité, une combinaison rare.
"Lors de l'administration d'ARNm thérapeutique dans les cellules, vous devez toujours équilibrer la puissance avec les effets secondaires toxiques, ", déclare Mitchell. "Notre laboratoire conçoit des nanoparticules lipidiques ionisables qui peuvent traverser en toute sécurité les membranes cellulaires, mais libèrent l'ARNm thérapeutique spécifiquement lorsqu'il doit être libéré. Nous voyons cela comme un énorme avantage, comme norme clinique actuelle, électroporation, tue une grande partie des cellules T du patient."
"En outre, " il dit, « nous envisageons une technologie de plate-forme pour la livraison de cellules T, comme nous pouvons fabriquer des ARNm pour différentes CAR thérapeutiques, ou d'autres récepteurs thérapeutiques, très rapidement en modifiant simplement la séquence d'ARNm, et donc ayant une variété d'applications thérapeutiques."
Avec des expériences in vitro, les chercheurs ont montré que leurs nanoparticules généraient des cellules CAR T qui étaient aussi efficaces pour tuer les cellules cancéreuses que les cellules CAR T génétiquement modifiées actuellement en usage clinique. Les prochaines étapes comprendront des études in vivo sur les impacts de ce système de livraison, examiner les effets de l'expression transitoire de CAR sur l'efficacité thérapeutique et les effets secondaires.
"Compte tenu de la boîte à outils croissante des thérapies à base d'ARN, l'administration de nanoparticules d'ARN a de larges applications pour l'ingénierie des cellules T, y compris l'édition génétique de l'ADN des cellules T et la modulation de l'expression des protéines, " dit juin.