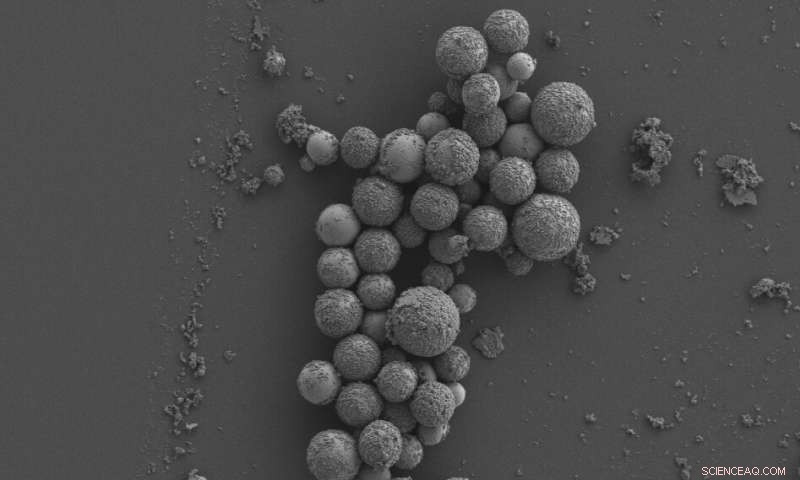
Crédit :Université RMIT
Les chercheurs ont utilisé des métaux liquides pour développer une nouvelle technologie de destruction des bactéries qui pourrait être la réponse au problème mortel de la résistance aux antibiotiques.
La technologie utilise des nanoparticules de métal liquide magnétique pour déchiqueter les bactéries et le biofilm bactérien – la « maison » protectrice dans laquelle les bactéries se développent – sans endommager les bonnes cellules.
Publié dans ACS Nano , la recherche menée par l'Université RMIT offre une nouvelle direction révolutionnaire dans la recherche de meilleures technologies de lutte contre les bactéries.
La résistance aux antibiotiques est une menace majeure pour la santé mondiale, causant au moins 700, 000 morts par an. Sans action, le nombre de morts pourrait atteindre 10 millions de personnes par an d'ici 2050, dépassant le cancer comme cause de décès.
Les plus gros problèmes sont la propagation de substances dangereuses, les superbactéries résistantes aux médicaments et la croissance d'infections à biofilm bactérien, qui ne peuvent plus être traités avec les antibiotiques existants.
Le Dr Aaron Elbourne a déclaré que les antibiotiques avaient révolutionné la santé depuis leur découverte il y a 90 ans, mais qu'ils perdaient de leur efficacité en raison d'une mauvaise utilisation.
"Nous nous dirigeons vers un avenir post-antibiotique, où les infections bactériennes courantes, les blessures mineures et les chirurgies de routine pourraient redevenir mortelles, " Elbourne, un post-doctorant au Laboratoire de nanobiotechnologie du RMIT, mentionné.
"Il ne suffit pas de réduire l'utilisation d'antibiotiques, nous devons repenser complètement la façon dont nous combattons les infections bactériennes.
"Les bactéries sont incroyablement adaptables et au fil du temps, elles développent des défenses contre les produits chimiques utilisés dans les antibiotiques, mais ils n'ont aucun moyen de faire face à une attaque physique.
« Notre méthode utilise des métaux liquides conçus avec précision pour déchirer physiquement les bactéries en lambeaux et briser le biofilm où les bactéries vivent et se multiplient.
"Avec le développement ultérieur, nous espérons que cette technologie pourrait être le moyen de contribuer à l'histoire de la résistance aux antibiotiques."
Passons au physique :une nouvelle façon de tuer les bactéries
L'équipe RMIT à l'origine de la technologie est le seul groupe au monde à étudier le potentiel antibactérien des nanoparticules de métal liquide magnétique.
Lorsqu'il est exposé à un champ magnétique de faible intensité, ces gouttelettes de taille nanométrique changent de forme et développent des arêtes vives.
Lorsque les gouttelettes sont mises en contact avec un biofilm bactérien, leurs mouvements et leurs bords nano-tranchants brisent le biofilm et rompent physiquement les cellules bactériennes.
Dans la nouvelle étude, l'équipe a testé l'efficacité de la technologie contre deux types de biofilms bactériens (Gram-positif et Gram-négatif).
Après 90 minutes d'exposition aux nanoparticules métalliques liquides, les deux biofilms ont été détruits et 99% des bactéries étaient mortes. Surtout, des tests de laboratoire ont montré que les gouttelettes destructrices de bactéries n'affectaient pas les cellules humaines.
Le boursier postdoctoral, le Dr Vi Khanh Truong, a déclaré que la technologie polyvalente pourrait un jour être utilisée de diverses manières pour traiter les infections.
"Il pourrait être utilisé comme revêtement par pulvérisation pour les implants, pour les rendre puissamment antibactériens et réduire les taux élevés d'infection pour les procédures telles que les arthroplasties de la hanche et du genou, " dit Truong, actuellement à l'Université d'État de Caroline du Nord grâce à une bourse Fulbright pour faire avancer la recherche.
"Il est également possible de développer cela en un traitement injectable qui pourrait être utilisé sur le site de l'infection."
La prochaine étape de la recherche - tester l'efficacité de la technologie dans des essais précliniques sur les animaux - est déjà en cours, l'équipe espérant passer aux essais cliniques sur l'homme dans les années à venir.
Dirigé par Truong, Elbourne et le Dr James Chapman, l'équipe multidisciplinaire prévoit également d'étendre la technologie au-delà du traitement antibactérien, explorer comment il pourrait être utilisé pour :