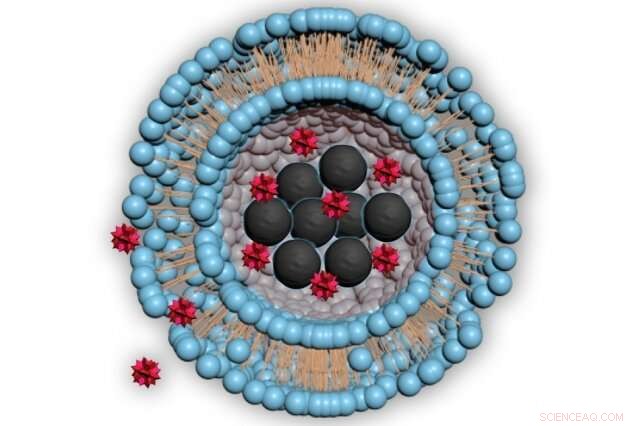
Le diagramme illustre la structure des minuscules bulles, appelés liposomes, utilisé pour livrer des médicaments. Les sphères bleues représentent les lipides, une sorte de molécule de graisse, entourant une cavité centrale contenant des nanoparticules magnétiques (noir) et le médicament à délivrer (rouge). Lorsque les nanoparticules sont chauffées, le médicament peut s'échapper dans le corps. Crédit :Massachusetts Institute of Technology
La plupart des produits pharmaceutiques doivent être ingérés ou injectés dans le corps pour faire leur travail. Dans les deux cas, il leur faut un certain temps pour atteindre les objectifs visés, et ils ont également tendance à s'étendre à d'autres zones du corps. Maintenant, des chercheurs du MIT et d'ailleurs ont développé un système pour fournir des traitements médicaux qui peuvent être libérés à des moments précis, de façon mini-invasive, et qui, en fin de compte, pourraient également administrer ces médicaments à des zones spécifiquement ciblées, telles qu'un groupe spécifique de neurones dans le cerveau.
La nouvelle approche est basée sur l'utilisation de minuscules particules magnétiques enfermées dans une minuscule bulle creuse de lipides (molécules grasses) remplie d'eau, connu sous le nom de liposome. Le médicament de choix est encapsulé dans ces bulles, et peut être libéré en appliquant un champ magnétique pour chauffer les particules, permettant au médicament de s'échapper du liposome et dans le tissu environnant.
Les résultats sont rapportés aujourd'hui dans le journal Nature Nanotechnologie dans un article du postdoctorant du MIT Siyuan Rao, Professeur agrégé Polina Anikeeva, et 14 autres au MIT, Université de Stanford, Université de Harvard, et l'Ecole polytechnique fédérale de Zurich.
"Nous voulions un système capable de délivrer un médicament avec une précision temporelle, et pourrait éventuellement cibler un emplacement particulier, " explique Anikeeva. " Et si nous ne voulons pas que ce soit invasif, nous devons trouver un moyen non invasif de déclencher la libération."
Champs magnétiques, qui peut facilement pénétrer à travers le corps, comme le démontrent les images internes détaillées produites par l'imagerie par résonance magnétique, ou IRM, étaient un choix naturel. La partie difficile était de trouver des matériaux qui pourraient être déclenchés pour chauffer en utilisant un champ magnétique très faible (environ un centième de celui utilisé pour l'IRM), afin d'éviter d'endommager le médicament ou les tissus environnants, dit Rao.
Rao a eu l'idée de prendre des nanoparticules magnétiques, dont on avait déjà montré qu'ils pouvaient être chauffés en les plaçant dans un champ magnétique, et les emballer dans ces sphères appelées liposomes. Ce sont comme de petites bulles de lipides, qui forment naturellement une double couche sphérique entourant une goutte d'eau.
Lorsqu'il est placé à l'intérieur d'un champ magnétique à haute fréquence mais de faible force, les nanoparticules s'échauffent, réchauffer les lipides et leur faire passer du solide au liquide, ce qui rend la couche plus poreuse, juste assez pour permettre à certaines molécules de médicament de s'échapper dans les zones environnantes. Lorsque le champ magnétique est éteint, les lipides se resolidifient, empêchant de nouvelles versions. Heures supplémentaires, ce processus peut être répété, libérant ainsi des doses du médicament inclus à des intervalles contrôlés avec précision.
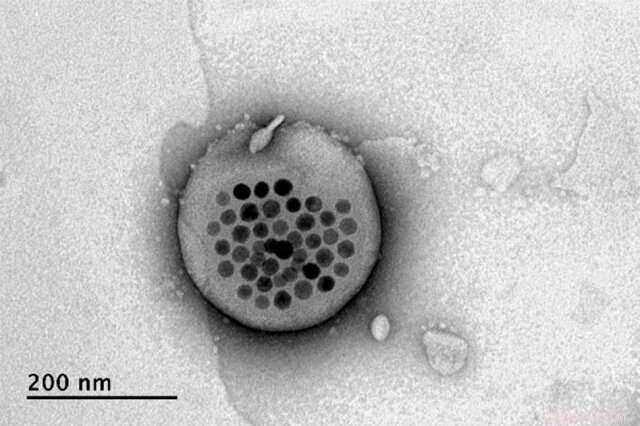
L'image au microscope électronique montre le liposome réel, la tache blanche au centre, avec ses particules magnétiques apparaissant en noir en son centre. Crédit :Massachusetts Institute of Technology
Les transporteurs de médicaments ont été conçus pour être stables à l'intérieur du corps à la température corporelle normale de 37 degrés Celsius, mais capables de libérer leur charge utile de médicaments à une température de 42 degrés. "Nous avons donc un interrupteur magnétique pour l'administration de médicaments, " et cette quantité de chaleur est suffisamment faible " pour que vous ne causiez pas de dommages thermiques aux tissus, " dit Anikeeva, qui occupe des postes dans les départements de science et génie des matériaux et des sciences du cerveau et cognitives.
En principe, cette technique pourrait également être utilisée pour guider les particules vers des localiser des emplacements dans le corps, en utilisant des gradients de champs magnétiques pour les pousser, mais cet aspect du travail est un projet en cours. Pour l'instant, les chercheurs ont injecté les particules directement dans les emplacements cibles, et en utilisant les champs magnétiques pour contrôler le moment des libérations de médicaments. « La technologie va nous permettre d'aborder l'aspect spatial, " Anikeeva dit, mais cela n'a pas encore été démontré.
Cela pourrait permettre des traitements très précis pour une grande variété de conditions, elle dit. « De nombreux troubles cérébraux se caractérisent par une activité erronée de certaines cellules. Lorsque les neurones sont trop ou pas assez actifs, qui se manifeste par un trouble, comme la maladie de Parkinson, ou dépression, ou l'épilepsie." Si une équipe médicale voulait administrer un médicament à un patch spécifique de neurones et à un moment donné, comme lorsqu'un début de symptômes est détecté, sans soumettre le reste du cerveau à ce médicament, ce système "pourrait nous donner un moyen très précis de traiter ces conditions, " elle dit.
Rao dit que la fabrication de ces liposomes activés par des nanoparticules est en fait un processus assez simple. "Nous pouvons préparer les liposomes avec les particules en quelques minutes dans le laboratoire, " elle dit, et le processus devrait être "très facile à étendre" pour la fabrication. Et le système est largement applicable pour l'administration de médicaments :« nous pouvons encapsuler n'importe quel médicament soluble dans l'eau, " et avec quelques adaptations, d'autres médicaments aussi, elle dit.
L'une des clés du développement de ce système a été de perfectionner et de calibrer un moyen de fabriquer des liposomes d'une taille et d'une composition très uniformes. Il s'agit de mélanger une base aqueuse avec les molécules lipidiques d'acides gras et les nanoparticules magnétiques et de les homogénéiser dans des conditions contrôlées avec précision. Anikeeva compare cela à secouer une bouteille de vinaigrette pour mélanger l'huile et le vinaigre, mais en contrôlant le timing, direction et la force de l'agitation pour assurer un mélange précis.
Anikeeva dit que même si son équipe s'est concentrée sur les troubles neurologiques, comme c'est leur spécialité, le système d'administration du médicament est en fait assez général et pourrait être appliqué à presque n'importe quelle partie du corps, par exemple pour livrer des médicaments contre le cancer, ou même d'administrer des analgésiques directement sur une zone touchée au lieu de les administrer de manière systémique et d'affecter tout le corps. « Cela pourrait le livrer là où il est nécessaire, et ne pas le livrer en continu, " mais seulement au besoin.
Parce que les particules magnétiques elles-mêmes sont similaires à celles déjà largement utilisées comme agents de contraste pour les IRM, le processus d'approbation réglementaire de leur utilisation peut être simplifié, car leur compatibilité biologique a été largement prouvée.