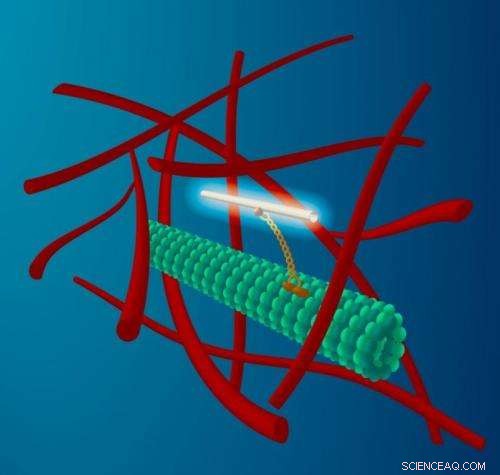
Un fin nanotube de carbone est attaché à un moteur moléculaire (jaune) qui se déplace le long des filaments de microtubules (vert) qui forment le réseau de transport des cellules. Ce transport se produit dans l'environnement très encombré du cytoplasme qui comprend un réseau de filaments d'actine (rouge). Le nanotube fluorescent sert de balise à la fois pour le transport le long du microtubule, ainsi que le tremblement du microtubule par le cytoplasme environnant très agité. Crédit :M. Leunissen, Conception de données néerlandaise
(Phys.org) — Des ingénieurs chimistes de l'Université Rice et des biophysiciens de l'Université Georg-August Göttingen en Allemagne et de l'Université VU d'Amsterdam aux Pays-Bas ont réussi à suivre des molécules uniques à l'intérieur de cellules vivantes avec des nanotubes de carbone.
Grâce à cette nouvelle méthode, les chercheurs ont découvert que les cellules remuaient leur intérieur en utilisant les mêmes protéines motrices qui servent à la contraction musculaire.
L'étude, qui jette un nouvel éclairage sur les mécanismes de transport biologique dans les cellules, paraît cette semaine dans Science .
L'équipe a attaché des nanotubes de carbone pour transporter des molécules connues sous le nom de moteurs de kinésine afin de les visualiser et de les suivre lorsqu'elles se déplacent dans le cytoplasme des cellules vivantes.
"Je suis étonné de la polyvalence des nanotubes de carbone, " a déclaré le co-auteur Matteo Pasquali, a Rice professeur de génie chimique et biomoléculaire et de chimie. "Nous les utilisons pour un large éventail d'applications, de l'ingénierie des fibres conductrices à l'imagerie dans les cellules."
Les nanotubes de carbone sont des cylindres creux de carbone pur avec des parois d'un atome d'épaisseur. Ils émettent naturellement une fluorescence avec des longueurs d'onde proches de l'infrarouge lorsqu'ils sont exposés à la lumière visible, une propriété découverte à Rice par le professeur Rick Smalley il y a une décennie, puis exploitée par le professeur de Rice Bruce Weisman pour imager des nanotubes de carbone. Lorsqu'il est attaché à une molécule, les nanotubes d'auto-stop servent de minuscules balises qui peuvent être suivies avec précision sur de longues périodes de temps pour enquêter sur les petits, mouvements aléatoires à l'intérieur des cellules.
"Toute sonde pouvant s'accrocher à la longueur et à la largeur de la cellule, rude, le taudis, lutter contre des obstacles terribles, gagner et toujours savoir où se trouve sa protéine, est clairement une sonde avec laquelle il faut compter, " a déclaré l'auteur principal Nikta Fakhri, paraphrasant "Le guide de l'auto-stoppeur de la galaxie." Fakhri, qui a obtenu son doctorat Rice dans le laboratoire de Pasquali en 2011, est actuellement membre du programme Human Frontier Science à Göttingen.
"En réalité, la stabilité exceptionnelle de ces sondes a permis d'observer des mouvements intracellulaires allant de quelques millisecondes à quelques heures, " elle a dit.
Pour les transports longue distance, comme le long des longs axones des cellules nerveuses, les cellules emploient généralement des protéines motrices liées aux vésicules lipidiques, les « conteneurs de fret » de la cellule. Ce processus implique une logistique considérable :la cargaison doit être emballée, attaché aux moteurs et envoyé dans la bonne direction.
« Cette recherche a permis de découvrir un autre, mécanisme beaucoup plus simple pour le transport à l'intérieur de la cellule, " a déclaré le chercheur principal Christoph Schmidt, professeur de physique à Göttingen. "Les cellules s'agitent vigoureusement, un peu comme un chimiste accélérerait une réaction en secouant un tube à essai. Cela les aidera à déplacer des objets dans l'environnement cellulaire très encombré. »
Les chercheurs ont montré que le même type de protéine motrice utilisé pour la contraction musculaire est responsable de l'agitation. Ils sont arrivés à cette conclusion après avoir exposé les cellules à des médicaments qui suppriment ces protéines motrices spécifiques. Les tests ont montré que l'agitation était également supprimée.
Le cytosquelette mécanique des cellules est constitué de réseaux de filaments protéiques, comme l'actine. Au sein de la cellule, la protéine motrice myosine forme des faisceaux qui contractent activement le réseau d'actine pendant de courtes périodes. Les chercheurs ont découvert que le pincement aléatoire du réseau d'actine élastique par de nombreux faisceaux de myosine entraînait une agitation interne globale de la cellule. L'actine et la myosine jouent un rôle similaire dans la contraction musculaire.
Les mesures très précises des fluctuations internes dans les cellules ont été expliquées dans un modèle théorique développé par le co-auteur de VU Fred MacKintosh, qui a utilisé les propriétés élastiques du cytosquelette et les caractéristiques de génération de force des moteurs.
"La nouvelle découverte favorise non seulement notre compréhension de la dynamique cellulaire, mais pointe également des possibilités intéressantes dans la conception de matériaux techniques « actifs », " dit Fakhri, qui rejoindra bientôt la faculté du Massachusetts Institute of Technology en tant que professeur adjoint de physique. « Imaginez un appareil biomédical microscopique qui mélange de minuscules échantillons de sang avec des réactifs pour détecter les maladies ou des filtres intelligents qui séparent les matériaux spongieux des matériaux rigides. »