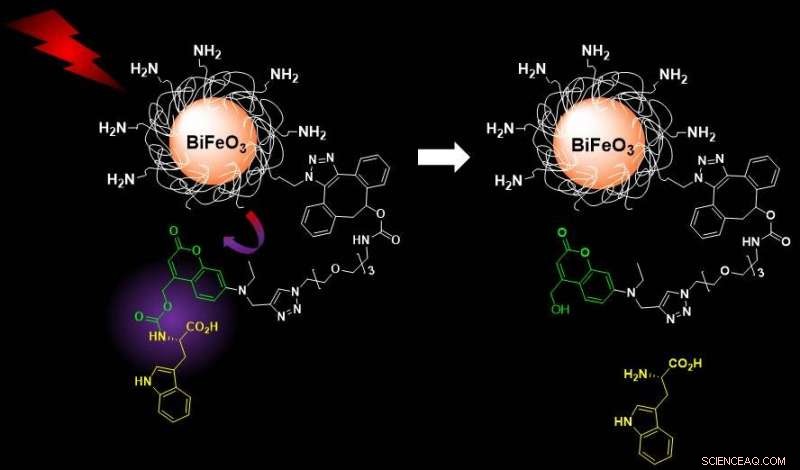
L'excitation dans le proche infrarouge de nanoparticules de ferrite de bismuth fonctionnalisées entraîne une émission harmonique qui déclenche la photolibération de cargaisons moléculaires en cage, permettant des applications d'imagerie découplée et de livraison contrôlée. Crédit :S. Gerber/EPFL
La théranostique est un domaine émergent de la médecine dont le nom est une combinaison de « thérapeutique » et de « diagnostic ». L'idée derrière la théranostique est de combiner des médicaments et/ou des techniques pour diagnostiquer et traiter simultanément ou séquentiellement des conditions médicales, et également surveiller la réponse du patient. Cela permet d'économiser du temps et de l'argent, mais peut également contourner certains des effets biologiques indésirables qui peuvent survenir lorsque ces stratégies sont utilisées séparément.
Aujourd'hui, les applications théranostiques utilisent de plus en plus des nanoparticules qui unissent des molécules de diagnostic et des médicaments en un seul agent. Les nanoparticules agissent en tant que transporteurs pour la « cargaison, " par exemple un médicament ou un radio-isotope pour les patients cancéreux subissant une radiothérapie, cibler des voies biologiques spécifiques dans le corps du patient, tout en évitant d'endommager les tissus sains.
Une fois sur leur tissu cible, les nanoparticules produisent des images diagnostiques et/ou livrent leur cargaison. Il s'agit de la technologie de pointe des « nanotheranostiques, " qui est devenu un axe majeur de recherche, mais avec de nombreuses limites à surmonter.
Maintenant, le laboratoire de Sandrine Gerber à l'EPFL, en collaboration avec des physiciens de l'Université de Genève, ont développé un nouveau système nanothéranostique qui surmonte plusieurs problèmes avec les approches précédentes. Le système utilise des « nanoparticules harmoniques » (HNP), une famille de nanocristaux d'oxyde métallique aux propriétés optiques exceptionnelles, en particulier leur émission en réponse à une excitation de l'ultraviolet à l'infrarouge, et leur grande photostabilité. C'est cette caractéristique qui a amené les HNP à la nanothéranose, lorsque les scientifiques essayaient de résoudre certains problèmes avec des sondes fluorescentes.
"La plupart des systèmes nanothéranostiques activés par la lumière ont besoin d'une lumière UV à haute énergie pour exciter leurs échafaudages photosensibles, " dit Gerber. " Le problème est que cela entraîne une faible profondeur de pénétration et peut endommager les cellules et les tissus vivants, ce qui limite les applications biomédicales.
Le nouveau système développé par le groupe de Gerber évite ces problèmes en utilisant des HNP de bismuth-ferrite revêtus de silice fonctionnalisés avec des cargaisons moléculaires en cage sensibles à la lumière. Ces systèmes peuvent être facilement activés avec une lumière proche infrarouge (longueur d'onde de 790 nanomètres) et imagés à une longueur d'onde plus longue pour les processus de détection et de libération de médicaments. Ces deux caractéristiques rendent le système médicalement sûr pour les patients.
Une fois déclenché par la lumière, les PNH libèrent leur cargaison - dans ce cas, L-tryptophane, utilisé comme modèle. Les scientifiques ont surveillé et quantifié la libération avec une technique qui combine la chromatographie liquide et la spectrométrie de masse, couvrant la partie imagerie-diagnostic du système nanothéranostique.
Les auteurs déclarent que « ce travail est une étape importante dans le développement de plates-formes de nanocarriers permettant une imagerie découplée en profondeur tissulaire et une libération à la demande de produits thérapeutiques ».