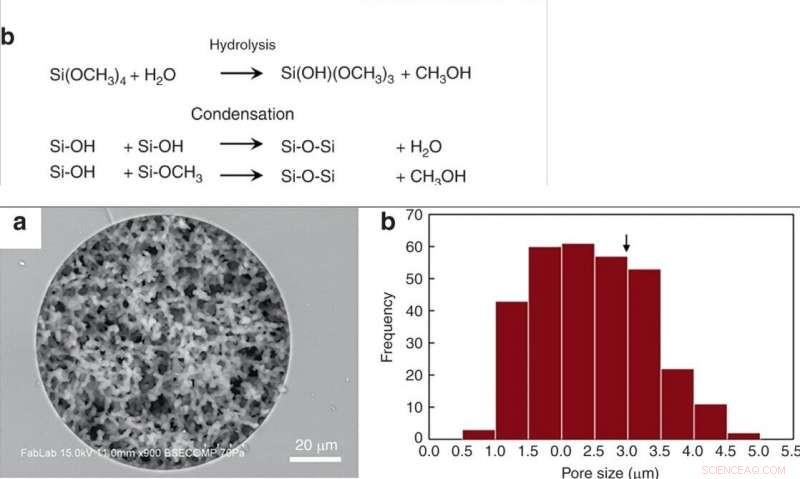
EN HAUT :(a) Synthèse de monolithe de silice poreuse dans un capillaire de silice fondue et un moule thermoplastique via la chimie sol-gel. (b) Réactions compétitives lors de la synthèse du monolithe. Les groupes silanol présents sur le capillaire en verre forment des liaisons covalentes avec le monolithe au cours de cette étape. EN BAS :(a) Image SEM d'un monolithe de silice synthétisé dans un capillaire de silice fondue de 100 m ID, révélant une porosité uniforme et un excellent ancrage mural du monolithe. (b) Histogramme de la taille des pores. Le diamètre critique pour l'hémolyse des globules rouges (2r*) est indiqué par une flèche. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0063-4
Les diagnostics monocellulaires émergents reposent sur le potentiel d'isoler rapidement et efficacement les bactéries à partir de matrices biologiques complexes. Dans une étude récente maintenant publiée dans Microsystèmes et nano-ingénierie , Jung Y. Han et ses collègues des départements interdisciplinaires de génie mécanique, Le génie biomoléculaire chimique et la bio-ingénierie aux États-Unis ont développé un dispositif pour isoler des bactéries intactes et viables du sang total à l'aide d'un système microfluidique, monolithe de silice poreuse. Ils ont obtenu une hémolyse mécanique tout en permettant le passage de bactéries intactes et viables à travers les monolithes pour un isolement bactérien basé sur la taille et une lyse sélective. Han et al. ont décrit un processus pour synthétiser de grandes quantités d'éléments monolithiques discrets liés à des capillaires et de briques monolithiques à l'échelle millimétrique à intégrer dans des puces microfluidiques.
Ils ont exploré l'impact de la morphologie monolithique, la géométrie et les conditions d'écoulement sur la lyse cellulaire et les régimes d'écoulement qui ont permis la lyse cellulaire sélective et le passage sélectif de plusieurs bactéries gram négatives et gram positives. La technique employée par Han et al. a permis une préparation rapide des échantillons et une analyse bactérienne lorsqu'ils sont combinés avec la spectrométrie Raman à cellule unique. Le travail fournit des étapes de préparation d'échantillons uniques pour soutenir une analyse bactérienne rapide et sans culture pour les applications dans les dispositifs biomédicaux au point de service.
Les bactéries dans le sang peuvent entraîner une septicémie, infection des tissus et autres conditions médicales graves, nécessitant une identification précoce des bactéries véhiculées par le sang pour un traitement efficace. La capacité d'identifier rapidement les bactéries à l'aide de diagnostics au point de service peut grandement améliorer le potentiel clinique d'un traitement optimal au cours d'une infection à un stade précoce. L'étalon-or existant pour la caractérisation bactérienne est basé sur l'analyse de culture cellulaire phénotypique et nécessite au moins 24 heures pour collecter des échantillons pour la culture et l'analyse dans un laboratoire de diagnostic et de microbiologie clinique. La technique existante est robuste et peu coûteuse, mais ne peut pas générer de résultats opportuns pour guider les étapes initiales du traitement.
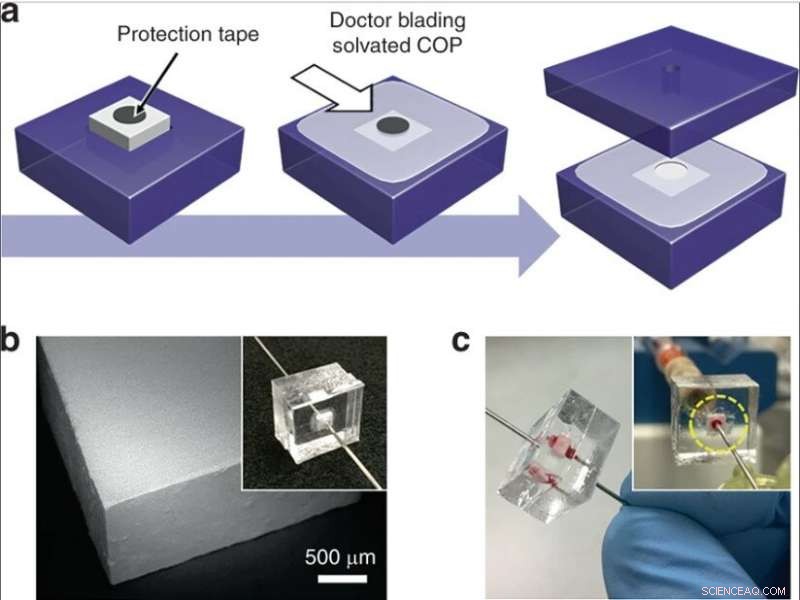
(a) Intégration d'une brique monolithe de silice dans une puce thermoplastique. Une bande circulaire est placée sur un monolithe inséré dans un substrat COP, et du COP solvaté est appliqué sur la surface exposée. Après séchage partiel, la bande est retirée, le dispositif est entouré d'un autre substrat COP, et des orifices de fluide sont insérés dans des trous qui fournissent un chemin d'écoulement à travers le monolithe. (b) Image SEM d'une brique monolithe coupée par une scie à découper en tranches. (c) Image d'un appareil pendant la perfusion de sang total. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0063-4
Dans le travail present, Han et al. ont exploré des dispositifs microfluidiques intégrés à des monolithes de silice poreuse en tant qu'éléments d'écoulement simples pour l'analyse sélective des cellules sanguines et l'isolement intact des bactéries. Les monolithes sont des matériaux hautement poreux composés d'une morphologie à cellules ouvertes avec des chemins tordus d'écoulement de fluide. Les scientifiques peuvent contrôler la morphologie des pores monolithiques via une contrainte de surface mécanique élevée pendant la perfusion cellulaire pour l'hémolyse mécanique des cellules sanguines, tout en permettant aux bactéries intactes et viables de parcourir les chemins d'écoulement sinueux pour leur isolement sans culture. Han et al. utilisé l'approche du passage sélectif des bactéries dans le sang total dans des conditions d'écoulement pour les espèces à Gram positif et à Gram négatif, malgré les différences des souches bactériennes. La technique de lyse monolithique sélective à haut débit combinée à des méthodes analytiques puissantes telles que la spectroscopie Raman peut permettre une analyse sans culture de bactéries dans le sang total au niveau de la cellule unique.
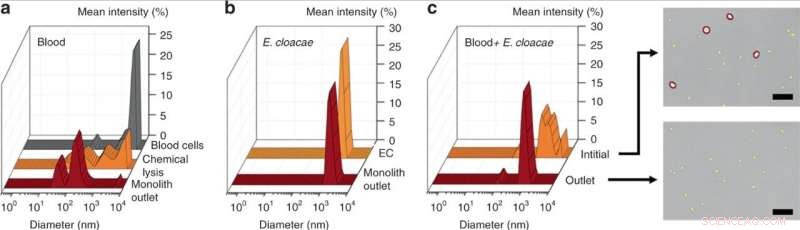
Mesure DLS de (a) sang dilué 25x initial, sang lysé chimiquement, et du sang lysé par perfusion à travers le dispositif monolithique, révélant une réduction significative de la taille des débris cellulaires pour la lyse mécanique des monolithes par rapport à la lyse chimique. (b) mesure DLS d'E. cloacae en suspension dans 1 × PBS, et échantillon perfusé à travers le dispositif monolithique, ne montrant aucun changement dans la taille des bactéries. (c) mesure DLS de sang dilué 100× dopé avec E. cloacae, et échantillon prélevé à la sortie d'un monolithe poreux. Le large pic dans l'échantillon d'entrée indique une population mixte de cellules sanguines et de petites cellules bactériennes, alors que l'échantillon de sortie a montré une réduction significative des grandes cellules (> 2 µm), comme le confirment les images optiques. Barres d'échelle = 25 µm. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0063-4
Han et al. des procédés de synthèse de monolithe de silice modifiés précédemment rapportés, suivi par l'hydrolyse et la condensation de la silice pour former du verre de silice à basse température. Pour préparer le monolithe de silice, les scientifiques ont utilisé une solution précurseur composée de silicates d'alkyle, polyéthylène glycol (PEG) comme porogène, l'urée comme source d'ions hydroxyle pour minimiser l'hétérogénéité et l'acide acétique. Lorsqu'ils ont optimisé le processus de synthèse, les monolithes résultants étaient homogènes et bien ancrés aux parois des capillaires de silice. Les scientifiques ont mesuré l'épaisseur de la structure monolithique finale du squelette et calculé sa perméabilité à l'aide de la chromatographie liquide à haute performance pour contrôler les conditions expérimentales. Pour minimiser la variation intrinsèque, Han et al. couper les tubes capillaires résultants en segments de 5 cm de long pour tester la perméabilité avant utilisation.
Ils ont ensuite développé deux méthodes complémentaires pour un fonctionnement à faible et à haut débit afin d'intégrer des monolithes de silice dans des systèmes microfluidiques. Pour permettre un fonctionnement à faible débit, les scientifiques ont intégré des segments capillaires contenant des monolithes dans des puces microfluidiques thermoplastiques pour protéger le monolithe pendant l'intégration. Pour la lyse sélective à haut débit, ils ont utilisé des monolithes avec des sections transversales plus grandes dans les dispositifs microfluidiques. La méthode complète de fabrication a donné une excellente fiabilité pour un fonctionnement sans fuite pendant la perfusion de sang total.
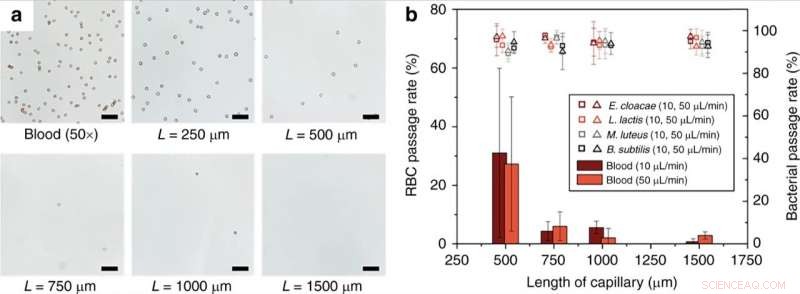
(a) Dépendance de la longueur du monolithe de l'hémolyse des globules rouges. Totalement, Du sang dilué 50x dans du PBS 1x a été perfusé à travers des monolithes capillaires de différentes longueurs à un débit de 10 μL/min. (b) Taux de passage des globules rouges et des bactéries viables à différents débits et longueurs de capillaire contenant des monolithes. Barres d'échelle = 50 µm. Les barres d'erreur sont ±1SD. Le contraste des images optiques a été ajusté pour la visibilité. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0063-4
Comme preuve de principe, Han et al. Enterobacter cloacae sélectionné (gram-négatif, bactéries en forme de bâtonnet) pour explorer leur efficacité de passage, aux côtés de trois bactéries gram-positives; Lactococcus lactis, Micrococcus luteus et Bacillus subtilis. Lors des expérimentations, ils ont perfusé des solutions bactériennes à travers les monolithes microfluidiques avec différentes géométries et conditions d'écoulement pour tester le passage des bactéries et la lyse des cellules sanguines à l'aide de la diffusion dynamique de la lumière (DLS). Par exemple, la perfusion d'E. cloacae purifiée à travers le monolithe n'a pas donné de changements discernables dans les pics de DLS, indiquant le passage intact des bactéries.
Les scientifiques ont montré l'effet de la longueur du dispositif monolithique poreux sur l'efficacité de la lyse des globules rouges (RBC). Les résultats ont indiqué que l'efficacité de la lyse des globules rouges augmentait significativement pour les longueurs de monolithe supérieures à 1 mm. Han et al. a également étudié le devenir des globules blancs (GB) lors du fonctionnement du dispositif monolithique, les cellules ne pouvaient pas traverser le monolithe sans être lysées de la même manière que les globules rouges. Techniquement, Les globules rouges se sont déformés en une forme discoïde pour traverser le monolithe, ce qui a entraîné une augmentation significative de la tension membranaire pour entraîner la lyse des globules rouges. Relativement, les cellules bactériennes avaient des dimensions similaires aux pores du monolithe et nécessitaient donc moins d'expansion de la paroi cellulaire pour un passage réussi sans rupture. Les scientifiques ont optimisé les paramètres de l'appareil pour que diverses bactéries tolèrent des niveaux élevés de stress membranaire sans rupture. Des développements ultérieurs ont assuré le passage intact des bactéries sans dégradation et avec viabilité.
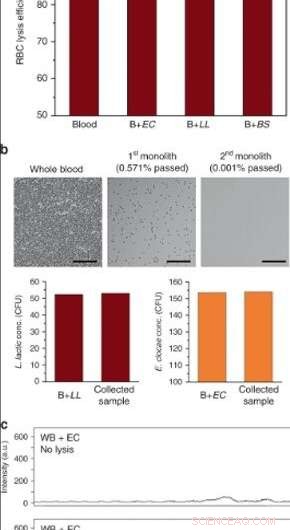
(a) Efficacité de lyse des globules rouges du sang total dans des dispositifs à haut débit après perfusion à 10 μL/min (EC E. cloacae, LL L. lactis, BS B. subtilis. Les barres d'erreur sont ±SD. N = 3 pour le sang et B + EC, et N = 2 pour B + LL, B + BS. (b) Lyse des cellules sanguines et séparation bactérienne après opération en série à l'aide de deux monolithes. Les surfaces ont été passivées avec du BSA/Tween 20. Plus de 99,999 % de lyse des globules rouges ont été obtenus tout en préservant la viabilité de L. lactis et E. cloacae. Barres d'échelle = 100 µm. c Spectres Raman de sang total enrichis d'E. cloacae (en haut) avant et (en dessous) après traitement à travers un monolithe de silice poreuse. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0063-4.
Pour un passage bactérien à haut débit, les scientifiques ont dilué le sang dans les appareils capillaires. Cependant, comme alternative, ils pourraient également étendre la capacité des monolithes à la lyse du sang total. Les appareils ont traité plus de 400 µL de sang total enrichi de bactéries avant de présenter une augmentation significative de la contre-pression, en raison du colmatage résultant de la lyse cellulaire et également en raison des leucocytes intacts (WBC) piégés dans la matrice poreuse.
Pour localiser les bactéries cibles, Han et al. obtenu un échantillon déposé sur une lame de verre, après avoir traversé le processus monolithique. Ils ont effectué une analyse Raman à cellule unique en balayant manuellement la sonde optique à travers l'échantillon. Ils attendent l'utilisation de la technologie de lyse sélective, couplée à la microscopie Raman confocale à l'avenir pour améliorer le processus de détection des souches bactériennes d'intérêt à de faibles concentrations dans un lieu d'intérêt défini.
De cette façon, Jung Y. Han et ses collègues ont développé un monolithe microfluidique pour isoler efficacement des bactéries intactes avec une large gamme de théranostic, point de service potentiel pour les applications cliniques. Ils envisagent l'union des outils de microscopie confocale Raman qui sont actuellement largement confinés au laboratoire de recherche avec des systèmes miniaturisés et portables émergents pour ouvrir la voie à des dispositifs de point de service rapides et portables.
© 2019 Réseau Science X