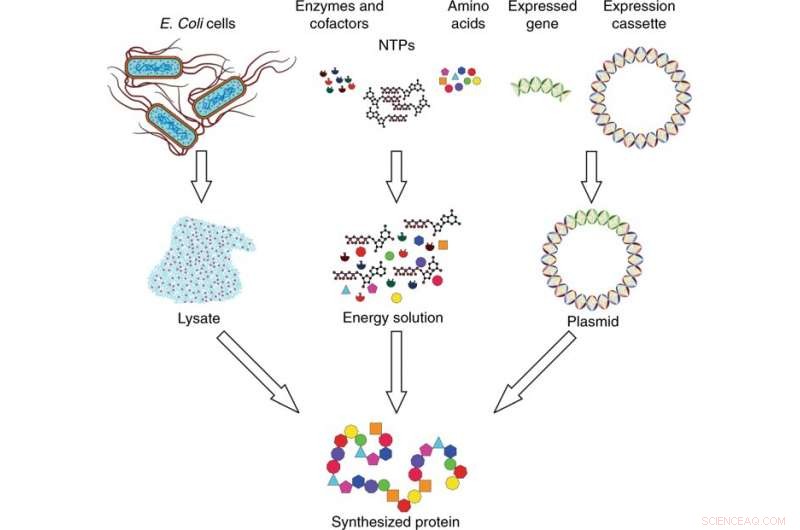
Présentation du système de synthèse des protéines acellulaires. Le système de synthèse est composé de trois composants :lysat, solution énergétique, et l'ADN plasmidique. Le lysat est collecté à partir de cellules E. coli par lyse cellulaire et préparé par ultracentrifugation. La solution énergétique est composée de nucléosides triphosphates (NTP), acides aminés, enzymes, et cofacteurs. L'ADN plasmidique est fabriqué en insérant le gène d'intérêt exprimé dans une cassette d'expression. Les trois composants sont combinés et incubés pour synthétiser la protéine d'intérêt. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0051-8
Les protéines thérapeutiques sont des candidats-médicaments à base de protéines bio-conçus en laboratoire pour des applications pharmaceutiques et cliniques. Sur la base de leur pharmacocinétique, les candidats peuvent être divisés en groupes qui (1) remplacent une protéine défectueuse ou anormale, (2) augmenter un chemin existant in vivo, (3) fournir une nouvelle fonction ou activité in vivo, (4) interférer avec les activités d'une molécule ou d'un organisme et (5) délivrer des protéines ou des composés encapsulés, y compris, médicaments cytotoxiques, radionucléide ou protéines effectrices.
Dans une étude récente publiée dans Microsystèmes et nano-ingénierie , Travis W. Murphy et ses collègues des départements d'ingénierie des systèmes chimiques et biologiques de Virginia Tech ont développé un plateforme de synthèse et de purification au point de service pour l'ingénierie des protéines. Ils ont construit un dispositif microfluidique intégré "Therapeutics-on-a-Chip (TOC)" pour synthèse de protéines thérapeutiques et purification de protéines thérapeutiques en une seule configuration.
La capacité de synthétiser des protéines thérapeutiques dans un environnement de point de service, peut réduire rapidement les coûts de stockage et de transport lors de la distribution mondiale dans les régions pauvres en ressources et contribuer au concept de science frugale. Une majorité de protéines sont actuellement produites à l'aide de systèmes de culture cellulaire tels que l'Escherichia coli recombinant, Levure, cellules de mammifères et cellules végétales pour une fabrication à grande échelle, après quoi ils sont distribués dans le monde entier à partir de fonderies centralisées. Cependant, la demi-vie limitée de ces protéines synthétiques nécessite des installations de stockage et d'expédition à basse température qui sont difficiles pour les patients vivant dans des régions éloignées et à faibles ressources.
Dans le travail present, Murphy et al. a d'abord démontré les principes de fonctionnement de l'appareil en exprimant et en purifiant une protéine rapporteur - la protéine fluorescente verte. Suivi par l'utilisation de COT pour produire de la cécropine B - un peptide antimicrobien largement utilisé pour contrôler les maladies du biofilm. Les scientifiques ont réussi à synthétiser et à purifier la cécropine B pour produire une concentration de 63 ng/µL en six heures, avec une pureté de 92 pour cent, suivi de la confirmation de ses propriétés antimicrobiennes avec un test d'inhibition de la croissance. La technologie TOC fournit une nouvelle plate-forme pour la synthèse et la purification des protéines au point de service pour des thérapeutiques cliniques accessibles.
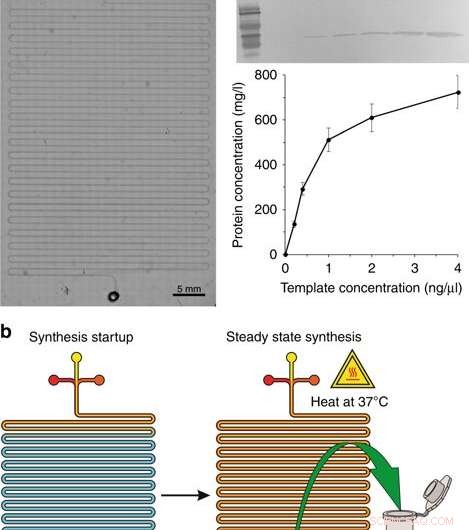
a) Une image microscopique du module de synthèse. b) Les étapes de la synthèse :démarrage de la synthèse et synthèse en régime permanent. c Western blot de la GFP produite dans le système CFPS et le rendement en protéines avec différentes concentrations de la matrice plasmidique. Un anticorps primaire monoclonal de souris 6 x His tag et un anticorps secondaire IgG anti-souris de chèvre conjugué à HRP (H + L) ont été utilisés pour détecter la protéine cible. Les concentrations indiquées sont les concentrations dans le volume réactionnel final. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0051-8
Les dispositifs de pointe actuellement utilisés pour la synthèse des protéines au point d'utilisation comprennent un système de la taille d'un réfrigérateur qui couvre un cycle de production-purification de deux jours pour fabriquer 800 doses d'un médicament par jour. Pourtant, le coût en capital associé à un tel système n'est pas réalisable dans le monde en développement, où la nécessité d'une production rapide de produits thérapeutiques de masse pour la distribution l'emporte sur la production de produits thérapeutiques de masse pour un stockage à long terme. Dans le système TOC développé par Murphy et al. les scientifiques ont réalisé la synthèse et la purification au point de service des protéines thérapeutiques à l'aide d'un processus de synthèse des protéines sans cellules (CFPS). Dans ce système, les protéines recombinantes ont été exprimées sans l'utilisation de cellules vivantes, adapté à la production au point de service, où les matières premières lyophilisées pourraient rester stables pendant le stockage dans une large plage de températures.
Parmi les protéines examinées dans l'étude, la cécropine B a une concentration inhibitrice minimale de 9,5 ng/µL pour exercer des effets antimicrobiens. En utilisant la configuration microfluidique, les scientifiques ont combiné la synthèse et la purification des protéines pour produire un peptide antimicrobien cécropine B à une dose cliniquement pertinente (63 ng/µL). La production en flux continu dans l'installation a été réalisée en trois phases de développement :
Murphy et al. utilisé un moulage de polydiméthylsiloxane (PMDS) à base de lithographie douce pour fabriquer les dispositifs ; construire des multicouches à l'aide de vannes micromécaniques.
Au cours de la première étape de conception du dispositif dans le réacteur CFPS, les scientifiques ont fabriqué une puce microfluidique à canal serpentin, similaire aux études précédentes pour la synthèse des protéines sur puce. Le dispositif microfluidique contenait des entrées reliées à une pompe à seringue placée sur la platine chauffante d'un microscope, où trois entrées ont reçu (1) le lysat cellulaire, (2) tampon de réaction CFPS et une (3) matrice d'ADN dans le long canal serpentin (environ 130 cm) avec une sortie. Les scientifiques ont alimenté les trois composants de la réaction à un débit combiné de 0,15 µL/min entraîné par une pompe à seringue pendant un temps de séjour de 1,5 heures. Ils ont chauffé le réacteur avec un réchauffeur d'étage (37 degrés C) et modélisé la configuration à l'aide du logiciel COMSOL Multiphysics pour vérifier la mécanique de l'appareil, pour un mélange et une réaction optimaux basés sur la diffusion sur puce. Pour valider les principes de fonctionnement du dispositif, Murphy et al. synthétisé la protéine rapporteur, GFP en utilisant une variété de modèles d'ADN. Le système a produit des volumes de protéines à un temps de réaction constant.
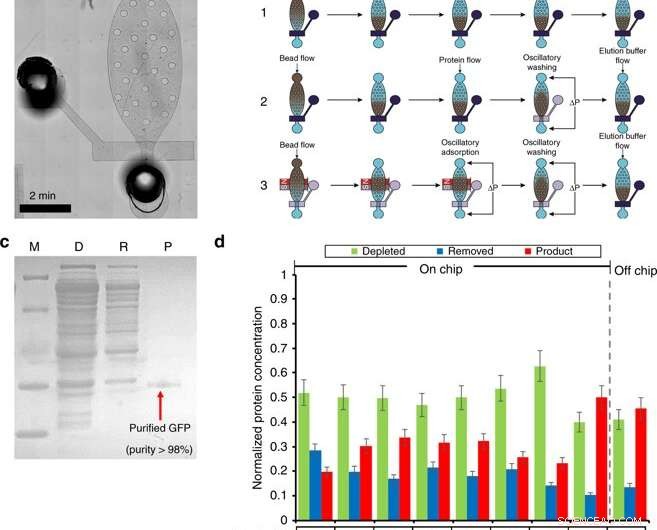
Purification des protéines dans une chambre microfluidique. a) Une image microscopique du module de purification. b) Présentation de la procédure de purification (y compris le chargement des billes, formation de lit, adsorption de protéines, la lessive, et élution) par trois workflows différents. Le flux de travail 1 utilise des étapes d'adsorption de flux et de lavage. Le flux de travail 2 utilise l'adsorption en flux et le lavage oscillatoire. Le flux de travail 3 utilise l'adsorption et le lavage oscillatoires. Le bleu foncé indique une vanne fermée, où la transparence dénote une vanne ouverte. c) SDS-PAGE de GFP purifiée par la puce de purification. M (marqueur) ; D (Épuisé) :mélange réactionnel CFPS après absorption des billes ; R (Supprimé) :les contaminants éliminés dans le tampon de purification ; P (Produit) :GFP purifiée dans le tampon d'élution. d) L'optimisation de l'étape de purification. L'optimisation a été réalisée en examinant 4 conditions. (1) volume de billes Ni-NTA de 5 ou 8 µl; (2) 0,5 % de Tween-20 ajouté dans les tampons de purification et d'élution. (3) Différents flux de travail. (4) Différents temps d'adsorption oscillatoire. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0051-8
Dans la deuxième phase, Murphy et al. conçu un dispositif microfluidique de purification de protéines basé sur un protocole d'adsorption et de lavage à haute efficacité, comme l'a démontré la même équipe de recherche précédemment. Ils ont fait fonctionner l'appareil à l'aide d'électrovannes pour contrôler la vanne micromécanique unique et les impulsions de pression oscillatoire associées pour effectuer la purification des protéines en quatre étapes principales.
Dans le flux de travail, les étapes étaient (1) le chargement des billes, (2) adsorption de protéines, (3) lavage et (4) élution. Pour optimiser le processus, les scientifiques ont compartimenté la méthode en trois flux de travail différents. Murphy et al. puis fait varier les conditions affectant les résultats de la purification des protéines pour atteindre une pureté du produit aussi élevée que 98,5 pour cent, avec un rendement de 54,6% du produit, surpassant les autres méthodes.
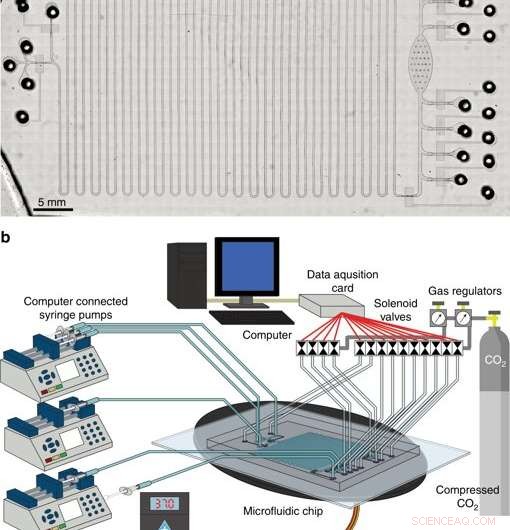
Le système intégré pour la synthèse et la purification de protéines sans cellules. a Micrographie de la plate-forme CFPS + P intégrée. b Présentation de la configuration de la plate-forme CFPS + P intégrée. Le système se compose d'électrovannes commandées par ordinateur et de pompes à seringue reliées à un dispositif microfluidique placé sur un étage de chauffage. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0051-8.
En phase trois, les scientifiques ont développé une plate-forme microfluidique intégrée avec synthèse et purification de protéines acellulaires (CFPS+P) pour l'automatisation. Ils associent un réacteur à flux continu et un dispositif de purification batch, bien que les deux processus n'étaient pas intrinsèquement compatibles l'un avec l'autre au départ. Pour obtenir une compatibilité adéquate, ils ont interfacé les deux processus à l'aide d'un tube réservoir qui stockait la protéine produite en continu sur une puce, avant la purification. Tous les appareils utilisés dans l'étude pour faire fonctionner le système microfluidique pourraient potentiellement avoir la taille d'une mallette, ce qui en fait un très portable, système de production de protéines thérapeutiques.
Au total, la puce CFPS+P entièrement intégrée contenait cinq étapes principales, notamment, amorçage, synthèse des protéines, adsorption de protéines, lavage et élution. Dans une sixième étape, les scientifiques ont arrangé le rafraîchissement des perles. Murphy et al. utilisé le canal de synthèse serpentin comme module de synthèse individuel, après avoir synthétisé la quantité désirée de protéine, ils arrêtent la configuration du module de purification pour lancer le processus de purification ultérieur. Pour tester le workflow de l'installation, les scientifiques ont utilisé la GFP et ont atteint une pureté de 98 pour cent.
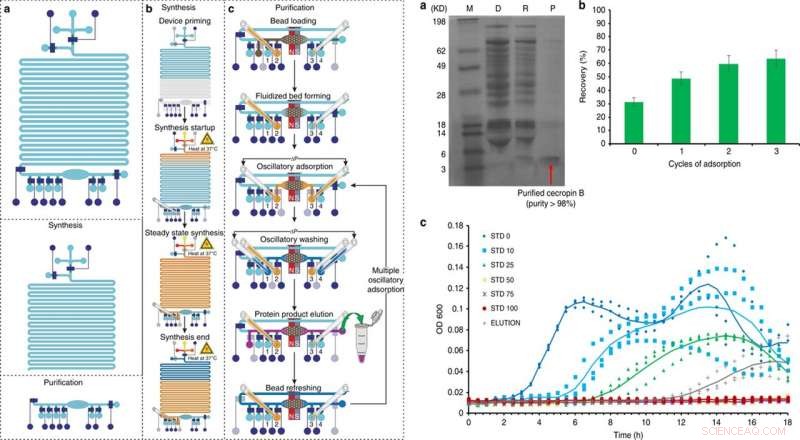
GAUCHE :Présentation et fonctionnement de la plateforme intégrée de synthèse et de purification de protéines acellulaires en 5 étapes principales :a) amorçage, b) la synthèse des protéines, c) adsorption de protéines, la lessive, et élution, avec une 6ème étape optionnelle de rafraîchissement des billes. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0051-8. DROITE :Synthèse et purification de Cecropin B à l'aide d'un dispositif microfluidique CFPS + P intégré. a) Tricine-PAGE de la cécropine B synthétisée et purifiée par la puce intégrée. M (marqueur); D (appauvri) :mélange réactionnel CFPS après absorption des billes ; R (supprimé) :contamine éliminé dans le tampon de purification ; P (produit) :AMP purifié dans le tampon d'élution. b) Optimisation de la récupération de la cécropine B en utilisant plusieurs cycles d'adsorption. c) Essais d'inhibition de la croissance d'E. coli réalisés en triple, en utilisant le produit protéique (élution) après trois cycles d'adsorption/élution par notre appareil en comparaison avec des standards de cécropine B de différentes concentrations (0-100 ng/μl, désigné par STD 0-100). La DO600 a été mesurée toutes les 30 min pendant 18 h. Une élution avec une concentration de 27 ng/μl dans 60 μl de solution a été utilisée. Des lignes de tendance qui représentent la moyenne de trois essais sont ajoutées pour guider l'œil. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0051-8.
Après optimisation du workflow CFPS+P à l'aide de GFP, les scientifiques ont utilisé la même configuration pour optimiser les conditions de synthèse de la cécropine B. En suivant les étapes d'expression, purification, électrophorèse et coloration dans le montage, Murphy et al. a confirmé la production et la purification réussies de la cécropine B et récupéré les protéines solubles pour éluer 63 ng/µL, avec une pureté de 92 pour cent. Ils ont ensuite testé la bioactivité de la cécropine B par rapport à E. coli inhibition pour démontrer une activité antibiotique réussie en inhibant la croissance bactérienne.
De cette façon, les protéines thérapeutiques synthétisées et purifiées à l'aide de la configuration microfluidique ont démontré une suppression active et efficace de la croissance bactérienne. Le système rentable peut être activement intégré dans des environnements à faibles ressources pour une science frugale. Murphy et al. l'intention d'automatiser complètement le système sur la base d'optimisations continues à l'avenir. Ils envisagent des applications de la configuration pour concevoir une gamme de protéines thérapeutiques diverses pour une production rentable au point de service.
© 2019 Réseau Science X