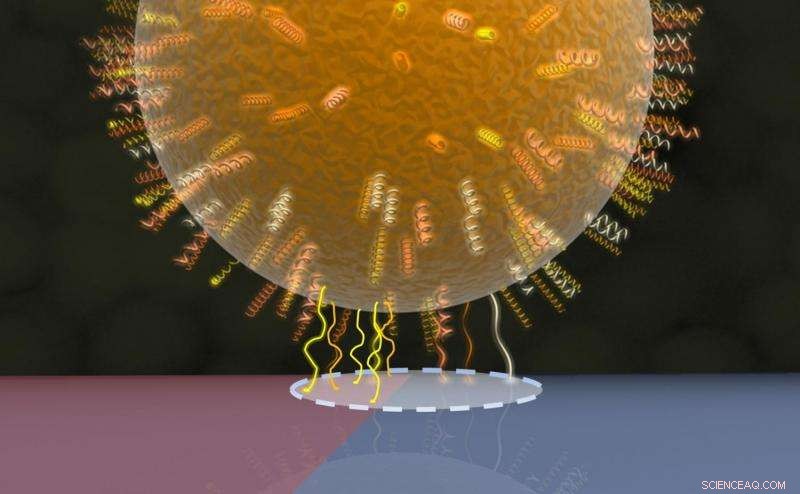
Modèle de la zone de contact bactérienne :les protéines de la paroi cellulaire dans une région circulaire (ligne pointillée) entrent en contact avec la surface sous-jacente, dont une moitié est représentée en rouge (région hydrophobe avec plus de contacts protéiques) et l'autre moitié en bleu (région hydrophile avec moins de contacts protéiques). Crédit :AG Jacobs
Une équipe de physiciens et de biologistes travaillant à l'Université de la Sarre a développé une méthode avec laquelle ils peuvent mesurer la zone de contact entre une bactérie et la surface sur laquelle elle est «assise». De façon intéressante, et peut-être contre-intuitivement, une grande surface de contact ne signifie pas nécessairement une grande force d'adhérence. Il s'avère que les caractéristiques spécifiques des bactéries, qui se traduisent par des différences locales dans la composition des protéines de la paroi cellulaire, sont les principales raisons des différences d'adhérence observées. Ces résultats peuvent maintenant être utilisés pour optimiser les matériaux antibactériens. Les travaux de recherche sont publiés aujourd'hui dans la revue Nanoéchelle .
Les bactéries de l'espèce Staphylococcus aureus sont parmi les agents pathogènes les plus répandus et les plus dangereux de notre époque. L'une des raisons de leur efficacité est leur capacité à adhérer aussi bien aux surfaces synthétiques qu'aux surfaces naturelles, où ils forment des biofilms très persistants. Ces biofilms protègent efficacement les agents pathogènes individuels, les rendant très difficiles à éliminer d'une surface. C'est pourquoi leur présence sur les implants médicaux est si redoutée et pourquoi ils sont une cause majeure d'infection post-opératoire. Une approche pour prévenir l'infection est donc d'empêcher la formation du biofilm. Mais pour pouvoir influencer la croissance du biofilm, les scientifiques doivent comprendre le mécanisme par lequel les bactéries adhèrent aux surfaces. Par exemple, il serait utile de savoir quelle fraction de la surface d'une seule cellule bactérienne est réellement en contact avec la surface. Cependant, comme ces bactéries sphériques ne mesurent qu'un micromètre de diamètre (environ un centième de l'épaisseur d'un cheveu humain), il était peu probable que la microscopie optique conventionnelle puisse être utilisée pour déterminer la zone de contact.
L'équipe de l'Université de la Sarre dirigée par la physicienne expérimentale professeur Karin Jacobs et le microbiologiste professeur Markus Bischoff a donc utilisé une autre propriété de la bactérie, à savoir que la force d'adhérence présentée par différentes espèces de bactéries dépend souvent fortement du type de surface sur laquelle elle est située. Par exemple, les bactéries qui ont fait l'objet de la présente étude adhèrent beaucoup plus efficacement aux surfaces fortement hydrophobes qu'aux surfaces mouillables (hydrophiles). Les chercheurs ont donc créé une surface à base de silicium qui présentait les deux propriétés - fortement hydrophobe dans une région, très mouillable dans un autre - dans une zone extrêmement petite. La force d'adhérence exercée par les bactéries individuelles sur cette surface spécialement préparée a ensuite été mesurée à l'aide d'un microscope à balayage à force atomique, connu sous le nom de spectroscope de force.
La méthode consiste à amener une seule cellule bactérienne en contact minimal avec la surface, puis à mesurer la force nécessaire pour détacher la bactérie de cette surface. C'est la force d'adhérence. Sur la partie hydrophobe (littéralement « détestant l'eau ») de la surface, la force est environ dix fois supérieure à celle nécessaire lorsque la cellule bactérienne adhère à la région hydrophile (« aimant l'eau »). Cette procédure est ensuite répétée avec la cellule bactérienne située successivement au plus près de la limite entre les régions hydrophobe et hydrophile, puis mesurer la force avec la bactérie située sur la frontière elle-même et enfin avec la bactérie située dans la zone purement hydrophile où la force d'adhérence est la plus faible. Les données de mesure reliant la force d'adhérence d'une seule cellule à sa position exacte sur la surface spécialement personnalisée, et donc à la mouillabilité de la surface, a permis à l'équipe de recherche de Sarrebruck de déduire la taille de la zone de contact entre la bactérie et la surface. La méthode peut également être utilisée pour d'autres mesures, telles que la détermination de la force d'adhérence des particules colloïdales, qui sont également de forme sphérique.
L'équipe de recherche a découvert que le diamètre de la zone de contact, qui était supposé circulaire, était de l'ordre de quelques dizaines à plusieurs centaines de nanomètres (un millier de nanomètres équivaut à un millième de millimètre) et que la taille de la zone de contact peut varier de manière significative entre différentes cellules individuelles d'une même espèce Staphylococcus aureus. A des fins de comparaison, un membre non pathogène du genre Staphylococcus a également été étudié qui adhère beaucoup moins fortement à la surface que le pathogène Staphylococcus aureus. Il est particulièrement étonnant que la taille de la zone de contact n'ait absolument aucun effet sur la force d'adhésion entre une cellule bactérienne et la surface. Les chercheurs ont également pu démontrer que malgré leur forme sphérique, les bactéries ne peuvent pas être décrites simplement comme des sphères dures lorsqu'elles interagissent avec une surface. Une description plus précise consiste à les considérer comme des balles recouvertes d'un doux, revêtement hirsute et inégal des protéines de la paroi cellulaire et que ce revêtement est le principal facteur déterminant l'adhérence entre la cellule et la surface. La variabilité locale prononcée de la force d'adhérence reflète les différentes compositions des groupes de protéines de la paroi cellulaire, qui déterminent la force avec laquelle une région de la surface de la cellule est capable d'adhérer à une surface.
L'approche utilisée dans l'étude peut, en principe, être appliqué à toutes les autres espèces d'agents pathogènes bactériens, qu'ils soient de forme sphérique ou en forme de bâtonnet. Les résultats pourraient bien ouvrir la voie à l'élaboration de surfaces dont la morphologie peut être soigneusement ajustée pour modifier ces forces d'adhérence, supprimant ainsi l'adhésion d'agents pathogènes bactériens indésirables, ou, alternativement, favoriser l'adhésion des bactéries, tels que ceux utilisés pour l'élimination des déchets, dont la présence est souhaitée.