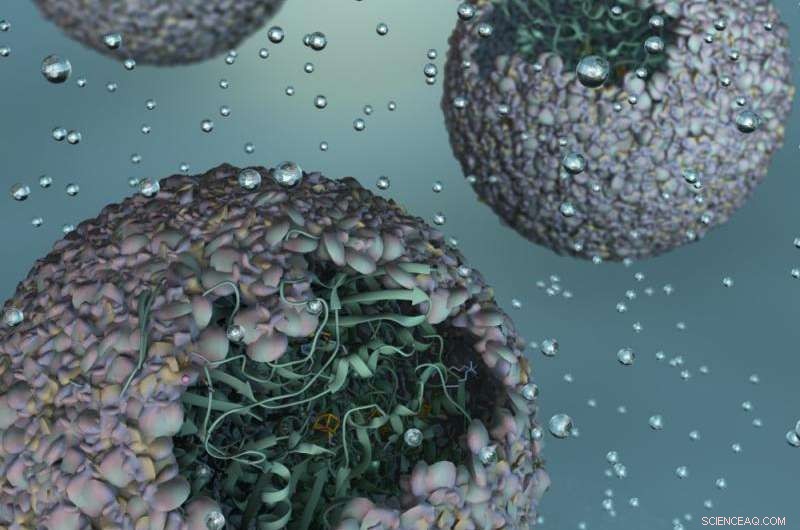
Vue d'artiste du P22-Hyd, un nouveau biomatériau créé en encapsulant une enzyme productrice d'hydrogène dans une enveloppe virale. Crédit :Université de l'Indiana
Des scientifiques de l'Université de l'Indiana ont créé un biomatériau hautement efficace qui catalyse la formation d'hydrogène, la moitié du « Saint Graal » consistant à séparer H2O pour produire de l'hydrogène et de l'oxygène pour alimenter des voitures bon marché et efficaces fonctionnant à l'eau.
Une enzyme modifiée qui gagne en force en étant protégée dans l'enveloppe protéique - ou "capside" - d'un virus bactérien, ce nouveau matériau est 150 fois plus efficace que la forme inchangée de l'enzyme.
Le processus de création du matériau a été récemment rapporté dans "Self-assembling biomolecular catalyseurs for hydrogene production" dans la revue Chimie de la nature .
"Essentiellement, nous avons pris la capacité d'un virus à auto-assembler une myriade de blocs de construction génétique et avons incorporé une enzyme très fragile et sensible avec la propriété remarquable d'absorber des protons et de cracher de l'hydrogène gazeux, " a déclaré Trevor Douglas, le professeur de chimie Earl Blough au département de chimie du IU Bloomington College of Arts and Sciences, qui a dirigé l'étude. "Le résultat final est une particule ressemblant à un virus qui se comporte de la même manière qu'un matériau hautement sophistiqué qui catalyse la production d'hydrogène."
Les autres scientifiques de l'IU qui ont contribué à la recherche étaient Megan C. Thielges, un professeur adjoint de chimie; Ethan J. Edwards, un doctorat étudiant; et Paul C. Jordan, chercheur postdoctoral chez Alios BioPharma, qui était un doctorat IU. étudiant au moment de l'étude.
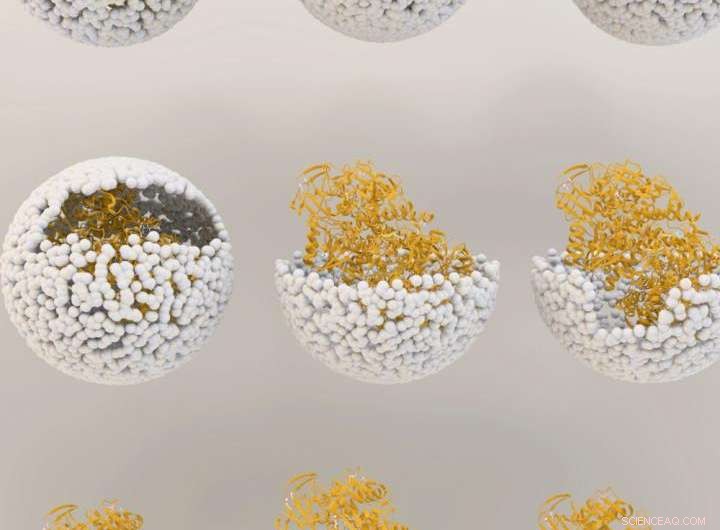
Illustration montrant la libération de NiFe-hydrogénase à l'intérieur de l'enveloppe du virus, ou "capside", du bactériophage P22. Crédit :Université de l'Indiana
Le matériel génétique utilisé pour créer l'enzyme, hydrogénase, est produit par deux gènes de la bactérie commune Escherichia coli, inséré à l'intérieur de la capside protectrice en utilisant des méthodes précédemment développées par ces scientifiques de l'UI. Les gènes, hyaA et hyaB, sont deux gènes dans E. coli qui codent pour des sous-unités clés de l'enzyme hydrogénase. La capside provient du virus bactérien connu sous le nom de bactériophage P22.
Le biomatériau résultant, appelé "P22-Hyd, " est non seulement plus efficace que l'enzyme non modifiée, mais est également produit par un simple processus de fermentation à température ambiante.
Le matériau est potentiellement beaucoup moins cher et plus respectueux de l'environnement à produire que les autres matériaux actuellement utilisés pour créer des piles à combustible. Le platine métal coûteux et rare, par exemple, est couramment utilisé pour catalyser l'hydrogène comme carburant dans des produits tels que les concept-cars haut de gamme.
"Ce matériau est comparable au platine, sauf que c'est vraiment renouvelable, " Douglas a dit. "Vous n'avez pas besoin de l'exploiter; vous pouvez le créer à température ambiante à grande échelle en utilisant la technologie de fermentation ; c'est biodégradable. C'est un processus très écologique pour fabriquer un matériau durable très haut de gamme."
En outre, P22-Hyd brise à la fois les liaisons chimiques de l'eau pour créer de l'hydrogène et fonctionne également en sens inverse pour recombiner l'hydrogène et l'oxygène pour générer de l'énergie. "La réaction fonctionne dans les deux sens - elle peut être utilisée soit comme catalyseur de production d'hydrogène, soit comme catalyseur de pile à combustible, ", a déclaré Douglas.
La forme de l'hydrogénase est l'une des trois présentes dans la nature :di-fer (FeFe)-, fer-seulement (Fe-seulement)- et nickel-fer (NiFe)-hydrogénase. La troisième forme a été sélectionnée pour le nouveau matériau en raison de sa capacité à s'intégrer facilement dans les biomatériaux et à tolérer l'exposition à l'oxygène.
NiFe-hydrogénase acquiert également une résistance significativement plus grande lors de l'encapsulation à la décomposition des produits chimiques dans l'environnement, et il conserve la capacité de catalyser à température ambiante. NiFe-hydrogénase non modifiée, par contre, est très sensible à la destruction par les produits chimiques dans l'environnement et se décompose à des températures supérieures à la température ambiante, ce qui fait de l'enzyme non protégée un mauvais choix pour une utilisation dans la fabrication et des produits commerciaux tels que les voitures.
Ces sensibilités sont « certaines des principales raisons pour lesquelles les enzymes n'ont pas encore tenu leurs promesses technologiques, " a déclaré Douglas. Une autre est leur difficulté à produire.
« Personne n'a jamais eu le moyen de créer une quantité suffisante de cette hydrogénase malgré son incroyable potentiel de production de biocarburant. " il a dit.
Le développement est très significatif selon Seung-Wuk Lee, professeur de bio-ingénierie à l'Université de Californie-Berkeley, qui ne faisait pas partie de l'étude.
"Le groupe de Douglas dirige le développement de nanomatériaux à base de protéines ou de virus au cours des deux dernières décennies. Il s'agit d'un nouveau travail de pionnier pour produire des carburants verts et propres pour s'attaquer au problème énergétique réel auquel nous sommes confrontés aujourd'hui et avoir un impact immédiat dans notre vie dans un futur proche, " dit Lee, dont les travaux ont été cités dans un rapport du Congrès américain sur l'utilisation de virus dans la fabrication.
Au-delà de la nouvelle étude, Douglas et ses collègues continuent de transformer le P22-Hyd en un ingrédient idéal pour l'énergie hydrogène en recherchant des moyens d'activer une réaction catalytique avec la lumière du soleil, au lieu d'introduire des élections en utilisant des méthodes de laboratoire.
« L'intégration de ce matériau dans un système à énergie solaire est la prochaine étape, ", a déclaré Douglas.