
Les scientifiques ont réussi à enregistrer le potentiel électrique à travers la membrane des cellules cardiaques en contraction (symbole). Crédit :Keystone / Science Photo Library / Beermedia / Fotolia / Montage
Pour la première fois, les scientifiques ont réussi à enregistrer le courant dans les canaux membranaires des cellules cardiaques en contraction. Pour faire ça, les scientifiques ont combiné un microscope à force atomique avec une méthode largement utilisée pour mesurer les signaux électriques dans les cellules.
Les impulsions électriques jouent un rôle important dans les cellules du corps humain. Par exemple, les neurones utilisent ces impulsions pour transmettre des informations le long de leurs branches et le corps les utilise également pour contrôler la contraction des muscles. Les impulsions sont générées lorsque des protéines de canaux spéciaux s'ouvrent dans l'enveloppe externe des cellules, permettant aux molécules chargées (ions) d'entrer ou de sortir de la cellule. Ces protéines sont appelées canaux ioniques. Depuis les années 1970, une méthode est à la disposition des chercheurs permettant de mesurer l'activité de ces canaux, mais jusqu'à présent, cette méthode a été utilisée principalement sur des cellules qui ne bougent pas. Les ingénieurs électriciens de l'ETH Zurich et les biologistes de l'Université de Berne ont maintenant développé la méthode plus avant, afin qu'ils puissent facilement enregistrer l'activité des cellules en mouvement, comme battre les cellules du muscle cardiaque dans une boîte de culture tissulaire.
La méthode existante consiste à positionner une pipette en verre contre la membrane externe d'une cellule. L'ouverture à la pointe de la pipette est si petite qu'elle ne touche qu'une fraction de la surface cellulaire. Idéalement, ce minuscule morceau de membrane cellulaire a exactement un canal ionique. L'intérieur de la pipette est rempli d'un fluide conducteur et d'une électrode, ce qui permet de mesurer les différences de charge entre la partie externe de la cellule et l'intérieur de la cellule (c'est-à-dire un potentiel électrique) et les variations temporaires de ce potentiel résultant de l'activité dans les canaux ioniques. La méthode est appelée technique du patch-clamp car la pipette est utilisée pour pincer un patch de la membrane cellulaire.
Microscope à force atomique avec aiguille de micro-injection
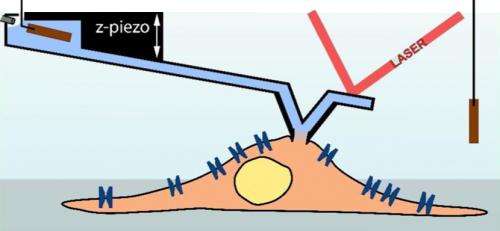
Une aiguille d'enregistrement au microscope à force atomique (bleu clair) sert de pipette pour mesurer une cellule (marron clair; schéma). (Illustration :Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society) Une aiguille d'enregistrement de microscope à force atomique (bleu clair) sert de pipette afin de mesurer une cellule (marron clair; schéma). Crédit :Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society
Dirigé par Tomaso Zambelli, professeur à l'Institut de génie biomédical de l'ETH Zurich, et Hugues Abriel, professeur au Département de recherche clinique de l'Université de Berne, les chercheurs ont maintenant combiné cette technique avec un microscope à force atomique. Une pointe de capteur est placée sur un support mobile - un soi-disant porte-à-faux - pour balayer la surface de l'objet microscopique. Il y a plusieurs années, les chercheurs ont réussi à produire des pointes de capteur avec un canal interne, qui permet l'injection contrôlée par ordinateur de molécules dans une cellule. Cette technique est désormais commercialisée par la spin-off de l'ETH Cytosurge. Cependant, les scientifiques ont poursuivi le développement de cette technique en équipant l'aiguille de micro-injection d'une électrode pour effectuer des mesures patch-clamp. Les chercheurs ont maintenant publié les résultats positifs de cette entreprise dans la revue Lettres nano .
La technique du patch-clamp n'est pas seulement une méthode centrale pour la recherche fondamentale en biologie cellulaire, il est également utilisé en routine dans le développement de nouveaux médicaments. Par exemple, l'industrie pharmaceutique est légalement tenue, dans le cadre du processus d'approbation des nouveaux médicaments, de tester si ces médicaments interagissent avec les canaux ioniques. Un médicament qui bloque les canaux ioniques peut provoquer une dysrythmie cardiaque sévère chez les patients, qu'il faut éviter à tout prix.
Mesures plus longues et automatisation possibles
Dans le cas de la technique classique du patch-clamp, un opérateur positionne manuellement la pipette contre la cellule; bien que des procédures automatisées existent, leurs applications sont limitées. Ainsi, les cellules testées doivent avoir la même taille et la même forme et ne doivent pas bouger (comme le font les cellules cardiaques).
Dans le cas de la nouvelle méthode, la micro-aiguille est contrôlée par un ordinateur utilisant des mesures de force du microscope à force atomique pour la maintenir à une courte distance constante de la surface de la cellule. "Cela rend le contact entre l'aiguille et la cellule beaucoup plus stable, ce qui nous permet de prendre des mesures sur une plus longue période de temps et même de tester des cellules en mouvement, " explique Zambelli. Pour la première fois, les chercheurs ont ainsi réussi à mesurer les changements de potentiel électrique dans les canaux ioniques des cellules cardiaques battantes. Zambelli dit qu'il peut également imaginer l'utiliser comme base pour le développement d'une méthode automatisée pour tester n'importe quelle cellule, quelle que soit sa forme ou sa taille.