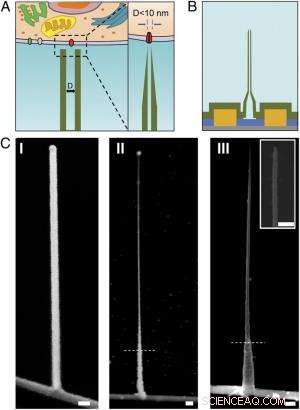
Schémas et images SEM de l'ultra-petit BIT-FET. ( UNE ) Illustration schématique d'une sonde bioélectronique intracellulaire. ( La gauche ) Schéma général d'une sonde pour l'enregistrement électrophysiologique intracellulaire. ( Droit ) Une vue agrandie de la pointe d'une sonde bioélectronique de moins de 10 nm et sa taille liée au canal ionique unique. ( B ) Structure schématique de l'ultra-petit BIT-FET. Vert, jaune, bleu, et les couleurs grises représentent SiO
(Phys.org) — Les sondes bioélectroniques miniaturisées vont transformer la biologie et la médecine en permettant la mesure des composants intracellulaires in vivo . Récemment, des scientifiques de l'Université Harvard et de l'Université de Pékin ont conçu, ont fabriqué et démontré des sondes bioélectroniques aussi petites que 5 nanomètres à l'aide d'une hétérostructure unique en trois dimensions de nanofils-nanotubes. (Une hétérostructure combine plusieurs hétérojonctions - interfaces entre deux couches ou régions de semi-conducteur cristallin dissemblable - dans un seul dispositif.) Grâce à des mesures expérimentales et des simulations numériques, les chercheurs ont montré que ces appareils ont une résolution temporelle suffisante pour enregistrer les signaux électriques les plus rapides dans les neurones et autres cellules, avec intégration dans des puces plus grandes, fournissant potentiellement une cartographie ultra-haute résolution de l'activité dans les réseaux neuronaux et autres systèmes biocellulaires.
Le professeur Xiaojie Duan a discuté du document qu'elle, Chercheur diplômé Tian-Ming Fu, Prof. Charles M. Lieber et leurs co-auteurs publiés dans Actes de l'Académie nationale des sciences . Elle souligne d'abord que les sondes à nanotubes et leur hétérojonction avec les transistors à effet de champ à nanofils de silicium (FET SiNW) deviennent mécaniquement moins stables à mesure que le diamètre est réduit. "Quand le nanotube devient de plus en plus petit, " Duan dit à Phys.org, "il devient plus facile de casser le nanotube au niveau de la zone de jonction avec le SiNW. Dans l'application de l'utilisation de la sonde pour la détection bioélectronique intracellulaire, il y aura diverses forces, comme la force capillaire du liquide, ainsi que l'interaction entre la sonde et la membrane cellulaire. Ces forces peuvent casser la sonde si nous avons une jonction faible entre elle et le SiNW."
Un autre problème est que la sensibilité électrique est également réduite à mesure que le diamètre des nanotubes diminue, parce que le diamètre interne (ID) du nanotube définit la zone de grille effective du dispositif. "Dans l'enregistrement du potentiel transmembranaire intracellulaire à l'aide de notre sonde, " Duan explique, "Le cytosol remplit le nanotube et agit comme électrode de grille pour le FET SiNW sous-jacent." Cytosol (aussi appelé liquide intracellulaire ou matrice cytoplasmique ) est le liquide trouvé à l'intérieur des cellules, à l'exclusion des organites et autres composants cytoplasmiques. "Le changement de potentiel du cytosol module la densité de porteurs du SiNW FET, modifiant ainsi sa conductance, " poursuit Duan. " C'est ainsi que fonctionne notre sonde pour l'enregistrement bioélectronique. " La zone de contact entre le cytosol et le SiNW - définie par le diamètre interne du nanotube - détermine l'efficacité de la modulation de la conductance. En d'autres termes, si le diamètre intérieur du nanotube est trop petit, la zone de grille SiNW FET sera également trop petite.
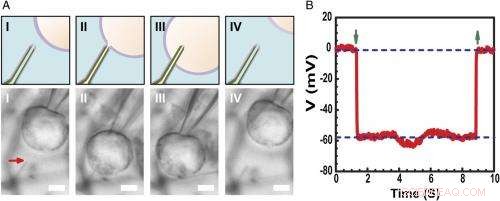
Enregistrement du potentiel de membrane au repos intracellulaire. ( UNE ) Schémas (en haut) et images de microscopie optique à contraste interférentiel différentiel ( Inférieur ) d'une cellule HL-1 manipulée par une micropipette en verre pour approcher ( je ), contact ( II ), pénétrer ( III ), et rétracter ( IV ) à partir d'une sonde BITFET ultra-petite modifiée par des phospholipides. La flèche rouge indique la position de la pointe du nanotube ultra-petit. Parce que du SiO pur
Les chercheurs ont également été informés du fait que la réponse dynamique à haute fréquence peut se dégrader avec la diminution du diamètre interne du nanotube en raison de l'augmentation de la résistance de la solution dans le nanotube. "Lorsque le diamètre intérieur du nanotube diminue, " Duan explique, "la résistance de la solution à l'intérieur du nanotube va augmenter, en raison de la diminution de la section transversale du conducteur de solution." De plus, la vitesse à laquelle le FET SiNW sous-jacent peut répondre à un signal est déterminée par le produit RC de la capacité et de la résistance du conducteur de solution à l'intérieur du nanotube - donc si le nanotube devient plus petit, la résistance est de plus en plus grande. Cela signifie que le FET SiNW aura besoin de plus de temps pour répondre - et si le changement de signal est trop rapide, la sonde ne pourra pas l'enregistrer de manière fiable. "C'est ce que nous entendons par" la réponse dynamique à haute fréquence se dégradera avec la diminution du diamètre interne des nanotubes, ' Duan ajoute, "Toutefois, nous avons trouvé que pour notre sonde, même si nous diminuons le diamètre intérieur du nanotube jusqu'à 5 nm, la sonde est toujours capable d'enregistrer fidèlement un signal de 3 kHz - une bande passante suffisante dans la plupart des cas pour enregistrer des signaux neuronaux et cardiaques."
Les chercheurs ont également été confrontés à la nécessité d'utiliser des détecteurs de transistors à effet de champ à nanofils semi-conducteurs actifs pour surmonter les limites de la réduction de la taille des sondes. « Le mot actif » est comparé à la nature « passive » de l'enregistrement avec des électrodes métalliques, " Duan souligne. "Pour l'enregistrement d'électrodes métalliques, une partie du potentiel transmembranaire V
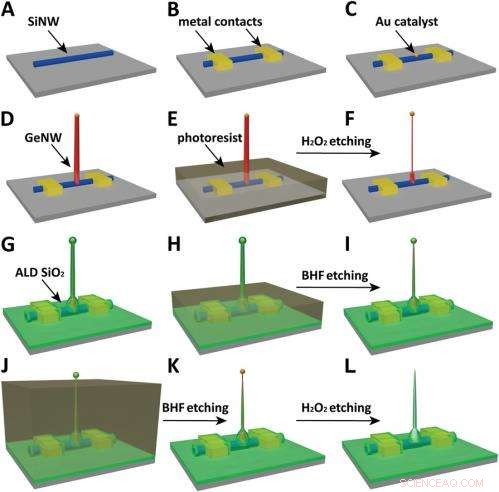
Schematics of the fabrication flow for the ultrasmall BIT-FET. ( UNE ) SiNWs (blue) are dispersed on substrate (solid gray). ( B ) S/D contacts are defined by EBL followed by thermal evaporation. ( C ) Au nanodots are defined on SiNWs between S/D using EBL and thermal evaporation. ( ré ) GeNWs (red) are grown on top of the SiNWs through nanocluster-catalyzed CVD process. ( E ) A thin layer of photoresist (transparent gray) is spin coated on the chip to protect the lower GeNW part. ( F ) The resulting H
Another critical challenge was synthetically integrating nanotubes and nanowires. "The nanotube is made of silicon oxide and the nanowire is made of silicon, " Du an notes. "For cell recording, the nanotube needs to be built vertically onto the nanowires – meaning that a three-dimensional heterostructure is needed." While the heterostructure could be fabricated in various ways, not all of them provided the required controllability at the probe scale. Par conséquent, the researchers grew a germanium nanowire (GeNW) on top of the silicon nanowires, with the GeNW acting as a template for the nanotube. "Depositing SiO
Finalement, the scientists had to investigate and model the bandwidth effect of phospholipid coatings, which are important for intracellular recording. "We use phospholipid coating to assist the nanotube probe to penetrate the cell membrane, " Duan notes. "Since the bandwidth of our probe is important for the probe to be able to record fast neural or cardiac signal, we need to make sure this phospholipid modification will not overly affect the bandwidth." Because the phospholipid layer will decrease the cross section of the solution conductor inside the nanotube, it impacts bandwidth in two ways by changing the capacitance and resistance of the solution inside the nanotube. (The phospholipid-modified probe bandwidth is easily determined by applying a fast artificial signal to the solution, and then recording how the conductance of the device changes over time. This provides the time the device needs to respond to this signal and thus the device's bandwidth.) "Therefore, " Duan explains, "if the nanotube is large, this thin phospholipid layer will not cause too much of a difference. Cependant, for our probe, the sub-10 nm nanotube size is almost the same scale as the lipid layer – so we have to carefully examine how it affects probe bandwidth, both experimentally and theoretically."
The scientists addressed these myriad challenges in designing, fabrication, and demonstrating the probe with three key innovations. "The first is the use of FET as potential sensing element, which in principle enables us to overcome the size limit on the probe." Duan explains. "However, FETs have conventionally existed in a linear geometry with connections that preclude access to the inside of cells." The second innovation was the solution to this problem – namely, the design of a vertical SiO
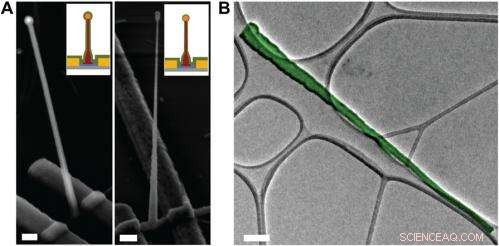
Electron microscopy characterization of the ultrasmall BIT-FET. ( UNE ) Representative SEM (Zeiss Ultra Plus field-emission SEM) images of intermediate fabrication steps of the ultrasmall BIT-FET. ( La gauche ) Device after 30-nm ALD coating of SiO
An important aspect of the study was ensuring that the bioelectronic devices had sufficient time resolution to record the fastest electrical signals in neurons and other cells. "The signals in neural system are normally in the millisecond scale, " Duan points out. "That means that to reliably record these signals, the recording device needs to have a bandwidth measure in kilohertz." While the probe's bandwidth decreases with the decrease of nanotube diameter, the scientists found that even for probes with inner diameters as small as 5 nm, the bandwidth is still around 3 kHz (a time resolution ~ 0.3 ms) in physiological solution. "This means that our probes have sufficient time resolution to record the fastest electrical signals in neurons and other cells, " Duan adds.
De plus, Duan points out, the scientists found that measuring the cell transmembrane resting potential with these ultrasmall bioelectronic devices demonstrates the capability for intracellular electrophysiology studies. "When we measured the transmembrane resting potential of HL-1 cell with our new probes, we found that with the phospholipid modification, the nanotube can easily and reliably penetrate the cell membrane, allowing the FET to record the intracellular transmembrane potential at full amplitude." After retracting the nanotube from the cell, the recorded potential can immediately revert to the extracellular potential. "Reliable cell membrane penetration and stable recording of intracellular transmembrane potential prove the capability of our probes for intracellular electrophysiology studies, " notes Duan.
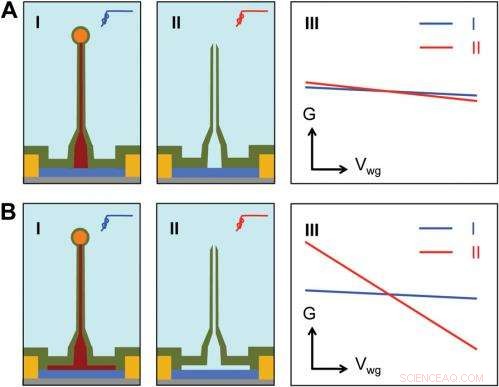
Sensitivity of different device structures. ( UNE , B ) Schematics of the ultrasmall BIT-FET without and with Ge overcoating on the SiNW, respectivement. je et II correspond to the BIT-FET devices before and after Ge core etching. III show schematically typical conductance ( g ) vs. water-gate (V
Avancer, says Duan, the researchers' are planning to scale up their work to integrate the probes into high-density, large-scale array for large-scale mapping of neural activities; use the probes to record neural signals from small subcellular structures/organelles; and investigate other applications in which the probes will provide substantially greater spatial resolution and minimal invasiveness than other techniques.
En outre, the scientists might consider developing other innovations. "Par exemple, " Duan illustrates, "a major challenge in using our ultra-small probes for recording from small subcellular structures is to accurately position them with respect to the subcellular structures of interest. We're looking at either labeling our probe with fluorescence dye – or other biocompatible materials – to mark the nanotube at high resolution, or using specific targeting in which the probe's biochemical surface groups define the specific cell location being studied."
Duan sees other areas of research that might benefit from their study, comprenant:
© 2014 Phys.org. Tous les droits sont réservés.