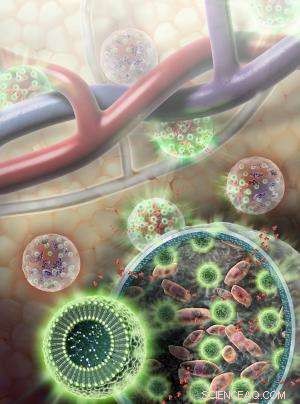
Les nanocapteurs (sphères vertes) sont composés de molécules de graisse et de L-arginine, ainsi que des molécules indicatrices séparées qui émettent des signaux lumineux et détectables par IRM lorsque les cellules sont vivantes. Les nanocapteurs sont enfermés dans une membrane d'hydrogel avec des cellules hépatiques (roses). Les nutriments et autres molécules relativement petites (rouge) sont capables de traverser la membrane d'hydrogel vers et depuis la circulation sanguine. Crédit :Sayo Studios
Des chercheurs de Johns Hopkins ont mis au point un moyen de détecter si des cellules précédemment transplantées dans un animal vivant sont vivantes ou mortes, une innovation qu'ils disent est susceptible d'accélérer le développement de thérapies de remplacement cellulaire pour des conditions telles que l'insuffisance hépatique et le diabète de type 1. Comme indiqué dans le numéro de mars de Matériaux naturels , l'étude a utilisé des capteurs de pH à l'échelle nanométrique et des appareils d'imagerie par résonance magnétique (IRM) pour déterminer si les cellules hépatiques injectées dans des souris survivaient au fil du temps.
"Cette technologie a le potentiel de transformer le corps humain en moins d'une boîte noire et de nous dire si les cellules transplantées sont encore en vie, " dit Mike McMahon, Doctorat., professeur agrégé de radiologie à la faculté de médecine de l'Université Johns Hopkins qui a supervisé l'étude. "Ces informations seront inestimables pour affiner les thérapies."
Les progrès de la médecine régénérative reposent sur des moyens fiables de remplacer les cellules endommagées ou manquantes, comme l'injection de cellules pancréatiques chez les personnes atteintes de diabète dont les propres cellules ne produisent pas assez d'insuline. Pour protéger les cellules transplantées du système immunitaire, tout en permettant la libre circulation des nutriments et de l'insuline entre les cellules et le corps, ils peuvent être enfermés dans des membranes d'hydrogel molles avant la transplantation. Mais, explique McMahon, "une fois que vous avez mis les cellules, vous n'avez vraiment aucune idée de combien de temps elles survivent. » De telles cellules transplantées finissent par cesser de fonctionner chez la plupart des patients, qui doit reprendre la prise d'insuline. À ce moment, les médecins ne peuvent que supposer que les cellules sont mortes, mais ils ne savent pas quand ni pourquoi, dit McMahon.
Avec ce problème à l'esprit, le groupe de McMahon, spécialisée dans les méthodes de détection des changements chimiques, collaboré avec le groupe de recherche dirigé par Jeff Bulte, Doctorat., le directeur de l'imagerie cellulaire à l'Institut d'ingénierie cellulaire de Hopkins. Le groupe de Bulte conçoit des moyens de suivre les cellules implantées dans le corps à l'aide de l'IRM. Dirigé par le chercheur universitaire Kannie Chan, Doctorat., l'équipe a conçu un très petit, ou à l'échelle nanométrique, capteur rempli de L-arginine, un supplément nutritionnel qui répond chimiquement aux petits changements d'acidité (pH) causés par la mort des cellules voisines. Les changements d'acidité déclencheraient à leur tour des changements dans les molécules de capteur intégrées dans la fine couche de graisse qui constitue l'extérieur de la nanoparticule, émettant un signal qui pourrait être détecté par IRM.
Pour tester le fonctionnement de ces nanocapteurs dans un corps vivant, l'équipe les a chargés dans des sphères d'hydrogel avec des cellules hépatiques - une thérapie potentielle pour les patients souffrant d'insuffisance hépatique - et un autre capteur qui émet une lumière bioluminescente uniquement pendant que les cellules sont vivantes. Les sphères ont été injectées juste sous la peau de souris. Comme le confirme le signal lumineux, l'IRM a détecté avec précision où les cellules étaient dans le corps et quelle proportion étaient encore en vie. (De tels indicateurs lumineux ne peuvent pas être utilisés pour suivre les cellules chez l'homme car notre corps est trop grand pour que les signaux visibles puissent passer, mais ces indicateurs ont permis à l'équipe de vérifier si les nanocapteurs IRM fonctionnaient correctement chez les souris.)
"C'était excitant de voir que cela fonctionne si bien dans un corps vivant, " dit Chan. L'équipe espère que parce que les composants du système—membrane d'hydrogel, molécules de graisse, et L-arginine-sont sans danger pour les humains, l'adaptation de leur découverte à une utilisation clinique s'avérera relativement simple. "Cela devrait éliminer beaucoup de conjectures de la transplantation de cellules en permettant aux médecins de voir si les cellules survivent, et sinon, quand ils meurent, " dit Chan. " De cette façon, ils pourront peut-être comprendre ce qui tue les cellules, et comment l'empêcher."
Les applications potentielles des capteurs ne se limitent pas aux cellules à l'intérieur des capsules d'hydrogel, Notes Bulte. "Ces nanoparticules fonctionneraient en dehors des capsules, et ils pourraient être associés à de nombreux types de cellules. Par exemple, ils peuvent être utilisés pour voir si les cellules tumorales meurent en réponse à la chimiothérapie, " il dit.